Boila (Mariota) likums — ideālo gāzu PV=k definīcija un piemēri
Boila (Mariota) likums — PV=k skaidrojums un piemēri: saprotami aprēķini spiediena un tilpuma attiecībai ar soli pa solim risinājumiem.
Boila likums (saukts arī par Mariota likumu vai Boila–Mariota likumu) apraksta ideālās gāzes uzvedību izotermiskā procesā — proti, ja gāzes daudzums un temperatūra ir nemainīgi.
Noteiktam ideālās gāzes daudzumam, kas tiek turēts nemainīgā temperatūrā, P (spiediens) un V (tilpums) ir apgriezti proporcionāli.
Vienkāršāk — nemainīgas masas ideālās gāzes tilpums izotermiskā procesā ir apgriezti proporcionāls tam pieliktajam spiedienam: samazinot tilpumu, proporcionāli palielinās spiediens, un otrādi.
P ∝ 1 V {\displaystyle P\propto {\frac {1}{V}}}
vai
P V = k {\displaystyle PV=k}
kur P ir gāzes spiediens, V ir gāzes tilpums un k ir konstante konkrētai gāzes masai un nemainīgai temperatūrai.
Intuitīvs skaidrojums
Apsveriet slēgtu trauku ar noteiktu gāzes daudzumu. Ja trauka tilpums samazinās, tās pašas daļiņas tagad izplata savus triecienus uz mazāku virsmu, tādēļ triecienu skaits uz vienību laukuma palielinās — spiediens pieaug. Pretēji, palielinot tilpumu, spiediens samazinās.
Saikne ar ideālās gāzes likumu
Boila likums ir ideālās gāzes likuma īpašs gadījums. No ideālās gāzes vienādojuma PV=nRT (kur n ir molu skaits, R — universālā gāzes konstante, T — absolūtā temperatūra) redzam, ka, ja n un T ir konstantas, tad PV = nRT = konstante, tātad PV = k.
Aprēķina piemērs
Iedomāsimies, ka sākotnējais stāvoklis ir P1 = 3 atm un V1 = 5 l. Spiediens samazinās līdz P2 = 2 atm. Lai atrastu jauno tilpumu V2, izmantojam vienādojumu:
P_{1}V_{1}=P_{2}V_{2}
Izteiksim V2:
V_{2}={\frac {P_{1}V_{1}}{P_{2}}}
Skaitliskā aizvietošana:
V_{2}={\frac {3\times 5}{2}}
V_{2}={\frac {15}{2}}=7{,}5
∴ Tilpums būs 7,5 litri.
Praktiskās pielietošanas piemēri
- Šļirces darbība — virzuļa kustība maina tilpumu un attiecīgi spiedienu, iegūstot vai izspiežot šķidrumu/gāzi.
- Pneimatiskās sistēmas un motori ar virzuļiem — darbības princips balstās uz tilpuma un spiediena attiecību.
- Elpošana — plaušu tilpuma izmaiņas maina intrapulmonālo spiedienu, nodrošinot gaisa plūsmu ievadīšanai vai izvadīšanai.
Ierobežojumi un novirzes
Boila likums der labi, ja gāze uzvedas ideāli — tas parasti nozīmē zemu spiedienu un salīdzinoši augstu temperatūru, tā, ka starpmolekulārās mijiedarbības ir nenozīmīgas. Reālās gāzes pieaugumam spiedienā vai pazeminātai temperatūrai var izrādīties būtiskas novirzes (piemēram, tuvojoties kondensācijas punktam). Turklāt likums attiecas uz izotermiskiem procesiem (temperatūra nemainīga).
Vēsturisks piezīme
Šo sakarību 1662. gadā noteica Roberts Boils, bet neatkarīgi no viņa līdzīga novērojuma 1679. gadā publicēja Edme Mariots. Tāpēc likums bieži tiek saukts par Boila–Mariota likumu.
Saistītie likumi
Boila likums ir viena no gāzu likumu grupas sastāvdaļām (kopā ar Čārlza un Gay-Lussac likumiem). To var apvienot kā kombinēto gāzu likumu: P V / T = konstante (ja gāzes daudzums n ir nemainīgs), un tālāk tas noved pie pilnīgā ideālās gāzes vienādojuma PV=nRT.
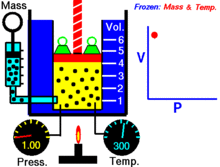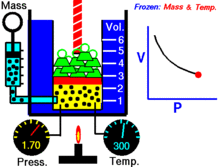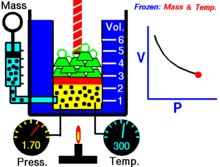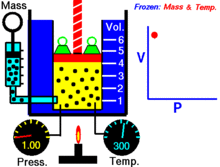
Animācija, kas parāda sakarību starp spiedienu un tilpumu.Gāzes daudzums un temperatūra ir nemainīgi.
Jautājumi un atbildes
J: Kas ir Boila likums?
A: Boila likums (saukts arī par Mariota likumu un Boila-Mariota likumu) ir likums par ideālajām gāzēm, kas nosaka, ka nemainīgā temperatūrā esošas ideālās gāzes nemainīgam daudzumam spiediens (P) un tilpums (V) ir apgriezti proporcionāli.
J: Kā Boila likumu var izteikt matemātiski?
A: Boila likumu matemātiski var izteikt kā P ∝ 1/V vai PV = k, kur P ir gāzes spiediens, V ir gāzes tilpums un k ir konstante.
J: Kas atklāja šo likumu?
A: Šo likumu 1662. gadā atklāja Roberts Boils, bet pēc tam 1679. gadā to neatkarīgi atklāja Edme Mariots.
J: Ko nozīmē, ja mēs sakām, ka P un V ir apgriezti proporcionāli?
A: Tas nozīmē, ka, vienam palielinoties, otrs proporcionāli samazinās - tātad, ja samazinās tilpums tvertnē, kurā ir noteikts gāzes daudzums ar noteiktu spiedienu, tad, palielinoties sadursmēm starp daļiņām, kas rodas, jo tās atrodas mazākā telpā, spiediens palielināsies.
J: Kā mēs izmantojam Boila likumu, lai aprēķinātu spiediena vai tilpuma izmaiņas?
A: Boila likumu varam izmantot, lai aprēķinātu spiediena vai tilpuma izmaiņas, izmantojot divus vienādojumus - P1V1=k un P2V2=k, kur k paliek nemainīgs, bet P1/V1 vai P2/V2 mainās atkarībā no tā, ko jūs mēģināt aprēķināt.
J: Vai šo likumu var piemērot arī reālām gāzēm?
A: Nē - tas attiecas tikai uz ideālajām gāzēm, jo starp tām nav starpmolekulāro spēku.
Meklēt





