Izolobala princips: definīcija, piemēri un nozīme organometālķīmijā
Izolobala princips organometālķīmijā: skaidra definīcija, ilustrēti piemēri un nozīme reakciju prognozēšanā — praktisks ceļvedis studentiem un pētniekiem.
Izolobala princips (pazīstams arī kā izolobala analoģija) ir konceptuāls rīks, ar kura palīdzību var paredzēt metālorganisko savienojumu saistīšanās un reaktivitātes iespējas, salīdzinot molekulārus fragmentus pēc to robežorbitāļu īpašībām. Organometālķīmijā tas attiecas uz to, kā organisko ligandu vai citu molekulāru fragmentu struktūra un orbitāļu raksturs var atbilst un mijiedarboties ar neorganiskiem (parasti metāla) fragmentiem. Roalds Hofmans (Roald Hoffmann) definēja izolobālus fragmentus kā tādus, kuriem robežorbitāļu skaits, simetrijas īpašības, aptuvenā enerģija un forma, kā arī elektronu skaits tajās ir līdzīgi — nevis identiski, bet pietiekami līdzīgi, lai paredzētu analoģiskas ķīmiskās saites un reakcijas.
Kas tiek salīdzināts — HOMO, LUMO un robežorbitāļi
Izolobāla analoģija balstās uz tādiem jēdzieniem kā augstākā aizņemtā molekulārā orbitāle (HOMO) un zemākā neieņemtā molekulārā orbitāle (LUMO). Ja diviem fragmentiem ir līdzīgas pierobežas (frontier) orbitāļu īpašības — forma, simetrija un enerģija —, tie var uzvesties līdzīgi saistoties ar citiem fragmentiem. Tāpēc mazāk izpētītu vai sarežģītāku fragmentu saistīšanos un reaktivitāti var prognozēt, izmantojot labi izprastu, izolobālu organisku vai neorganisku fragmentu uzvedību.
Piemēri un tipiskie salīdzinājumi
- Organiskie radikāļi pret metālu fragmentiem: bieži minēts piemērs ir metila radikāls CH3 un metāla fragments, kas nodrošina līdzīgu robežorbitāļu kopu — tādu tipa salīdzinājumu izmanto, lai prognozētu, kā var veidoties metilēšanas vai šķelšanas reakcijas metālorganiskos savienojumos.
- Ligandu aizvietojumi: izolobālā analoģija ļauj aizvietot vienu ligandu ar citu, saglabājot kopējo elektronisko vidi metāla centrā, ja abi ligandi ir izolobāli.
- Fragmentu projektēšana: retrosintētiskā pieeja organometāliskām konstrukcijām — sadalot komplekso savienojumu fragmentos un meklējot izolobālus ekvivalentus, ķīmiķi var izstrādāt jaunas sintezēšanas stratēģijas.
Nozīme organometālķīmijā
Izolobālā analogija ir noderīga instrumenta domāšanai un pedagōģiskai vizualizācijai: tā ļauj ķīmiķiem iedomāties metāla fragmentus tāpat kā organiskas grupas un izmantot pazīstamus organiskos modeļus, lai prognozētu saites, ģeometriju un reaktivitāti metālorganiskās ķīmijas problēmās. Tas palīdz formulēt hipotezes par iespējamiem produktiem, paredzēt katalītiskas reakcijas soļus un izprast, kā dažādi ligandi ietekmē metāla centra elektronisko struktūru.
Vizuālais attēlojums
Parasti izolobālus fragmentus attēlo grafiski: katra fragmenta robežorbitāle tiek attēlota kā puskopa vai bultiņa, un izolobālu pāri savieno ar divvirzienu bultiņu, kas norāda uz to analoģiju. Šāds attēlojums palīdz saprast, kuri orbitalu pāri var mijiedarboties, veidojot jaunas ķīmiskās saites.
Vēsturiskā nozīme un atzinības
Par izolobālās analoģijas izstrādi Roalds Hofmans 1981. gadā saņēma Nobela prēmiju ķīmijā, ko viņš dalīja ar Keniči Fukui. Hofmana Nobela lekcijā viņš uzsvēra, ka izolobālā analoģija ir lietderīgs un vienkāršs modelis, kas sniedz izpratni par saistību starp orbitalu simetriju, enerģiju un ķīmiskajām reakcijām.
Ierobežojumi un piesardzība
Jāņem vērā, ka izolobālā analoģija ir tikai modelis un reizēm var maldināt. Galvenie ierobežojumi:
- Modelis neņem pilnībā vērā atšķirības elektronnegativitātē starp oglekli un metālu, kas var mainīt orbitāļu enerģijas un saites polaritāti.
- Metālu d-orbitalu specifiskā loma, daudzcentru saites un koordinācijas ģeometrijas var novērst paredzamo uzvedību, ja tās nav iekļautas vienkāršā izolobālā attēlā.
- Ķīmiskais vide — šķīdinātājs, temperatūra, oksidācijas stāvoklis un kinētika — bieži nosaka, vai paredzētā saite var veidoties praksē.
- Relatīvistiskas vai daudzelektronu efekti, kā arī neparasti ligandu elektroniskie efekti var padarīt izolobālus salīdzinājumus mazāk uzticamus.
Kā izmantot izolobālo principu praksē
- Sākumā definējiet fragmentu robežorbitāļu skaitu, simetriju un aizpildījumu (elektronu skaitu).
- Salīdziniet šo informāciju ar labi izpētītiem fragmentiem (piemēram, organiskajiem radikāļiem), meklējot līdzību HOMO/LUMO enerģijās un formās.
- Izmantojiet kvantķīmiskās skaitļošanas metodes vai eksperimento gūtus datus, lai pārliecinātos, vai izolobālais salīdzinājums ir pamatots konkrētajā gadījumā.
- Vienmēr novērtējiet arī steriskos, termodinamiskos un kinētiskos faktorus, kas var ietekmēt reālo reakciju iznākumu.
Kopsavilkums
Izolobala princips ir noderīgs un intuitīvs rīks organometālķīmijā, kas palīdz sasaistīt organisko ķīmiju ar metālu ķīmiju, paredzēt saistību veidošanos un veidot jaunas sintezēšanas idejas. Tomēr tas nav universāls likums — tā lietderība ir atkarīga no tā, cik labi izolobālais salīdzinājums atspoguļo reālos orbitāļu enerģiju, simetriju un elektronisko vidi. Praktiskos pētījumos izolobālo pieeju parasti kombinē ar kvantķīmiskām aprēķinu metodēm un eksperimentāliem datiem, lai iegūtu drošākas prognozes.
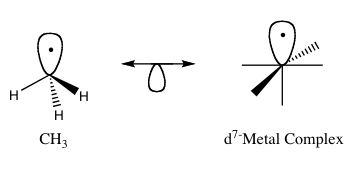
1. attēls: Izolobāla analoģijas pamatparaugs.
Jautājumi un atbildes
J: Kas ir izolobāla princips?
A: Izolobāla princips (pazīstams arī kā izolobāla analoģija) ir veids, kā paredzēt metālorganisko savienojumu saistvielu īpašības. Tas saista organisko ligandu struktūru, kas var saistīties ar neorganiskiem molekulāriem fragmentiem, salīdzinot to augstāko aizņemto molekulāro orbitāli (HOMO) un zemāko neaizņemto molekulāro orbitāli (LUMO).
J: Kas ierosināja izolobāla principu?
A: Roalds Hofmans ierosināja izolobāla principu.
J: Kā tas ir saistīts ar izoelektroniskajiem savienojumiem?
A: Izolobal savienojumi ir analogi izoelektroniskajiem savienojumiem, kuriem ir vienāds valences elektronu skaits un struktūra.
J: Ko Hofmans saņēma par savu darbu pie šīs koncepcijas?
A: Par darbu pie izolobālu analoģijas Hoffmann 1981. gadā saņēma Nobela prēmiju ķīmijā, ko viņš dalīja ar Kenichi Fukui.
J: Kā Hofmans aprakstīja molekulāros fragmentus?
A: Hofmans molekulāros fragmentus raksturoja kā izolobālus, "ja robežorbitāļu skaits, simetrijas īpašības, aptuvenā enerģija un forma, kā arī elektronu skaits tajās ir līdzīgi - nevis identiski, bet līdzīgi".
J: Kā šo modeli var izmantot, lai prognozētu saiti un reaktivitāti?
A: Var prognozēt mazāk zināmu detaļu saistīšanos un reaktivitāti, pamatojoties uz labāk zināmu detaļu saistīšanos un reaktivitāti, ja tām ir līdzīgas pierobežas orbitāles.
Vai šis modelis vienmēr darbojas pareizi?
A: Nē, dažos gadījumos tas neizdodas.
Meklēt