Ligandi — bioķīmija, funkcijas, saistīšanās un receptoru afinitāte
Ligandi — ceļvedis bioķīmijā: funkcijas, saistīšanās mehānismi, receptoru afinitāte, tipi (substrāti, inhibitori, aktivatori, neiromediatori) un loma šūnu signālu regulācijā.
Ligands ir bioķīmiska viela. Tās funkcija ir saistīties ar bioloģisko molekulu un likt tai veikt kādu funkciju. Saistoties ligandam, mainās receptora proteīna forma. Tas maina olbaltumvielas uzvedību.
Šaurākā nozīmē tā ir signālu ierosinoša molekula, kas saistās ar mērķa proteīna vietu.
Saistīšanās notiek, izmantojot starpmolekulārus spēkus, piemēram, jonu saites, ūdeņraža saites un van der Valsa spēkus. Savienošana (asociācija) parasti ir atgriezeniska (disociācija).
Ligandi ir substrāti, inhibitori, aktivatori un neiromediatori. Saistīšanās tendenci vai stiprumu sauc par afinitāti.
Kas ir ligands un ar ko tas saistās
Ligands var būt maza organiskā molekula, peptīds, olbaltumviela, jons vai pat cits nukleīnskābju fragments. Bieži mērķis (receptors) ir proteīns — piemēram, G olbaltumvielu saistītie receptori, enzīmi vai jonu kanāli — bet ligandi var saistīties arī ar DNS vai lipīdu membrānām. Saistīšanās vieta uz mērķa molekulas bieži saucas ligandu saistošā vieta (binding site), kurā ķīmiskā saderība un ģeometrija nosaka, vai ligands piesaistīsies.
Kā notiek saistīšanās — mijiedarbības veidi
- Ionu mijiedarbība (elektrostatiska) — starp pretēji lādētām daļām.
- Ūdeņraža saites — virsmas atomu orientācija un polaritāte nodrošina specifiskumu.
- van der Waals spēki un hidrofobs efekts — svarīgi pie ciešas kontaktēšanās un hidrofobu vietu sasaistes.
- Kovalentas saitēšanās — retāk, bet iespējama (piem., dažiem inhibitoriem), tā parasti ir neārstējami saistoša un maina proteīna funkciju ilgstoši.
Afinitāte, specifiskums un saistīšanās kinetika
Afinitāte apraksta, cik spēcīgi ligands saistās ar mērķi. To kvantitatīvi raksturo disociācijas konstante Kd, kas definēta kā Kd = [L][R]/[LR] (kur [L] — brīvais ligands, [R] — brīvais receptors, [LR] — komplekss). Zems Kd nozīmē augstu afinitāti. Afinitātes diapazons bioloģijā var būt no pM (ļoti augsta) līdz mM (ļoti zema).
Saistīšanās kinetika tiek aprakstīta ar asociācijas (kon) un disociācijas (koff) ātrumiem; Kd = koff/kon. Šie rādītāji noteic, cik ātri komplekts veidojas un cik ilgi tas pastāv.
Specifiskums nozīmē, cik selektīvi ligands saistās ar vienu mērķi salīdzinājumā ar citiem. Ligands var būt ar augstu afinitāti, bet zemu specifiskumu (tas saistās ar daudzām vietām), kas var radīt blakusparādības farmakoloģijā.
Funkcionālās klases un farmakoloģiskie termini
- Agonists — saistoties ar receptoru, izraisa tā aktivāciju un signāla pārvadi.
- Antagonists — saista receptoru, bet neaktivizē to; bloķē agonista darbību.
- Daļējs agonists — izraisa daļēju receptoru aktivāciju salīdzinājumā ar pilnu agonistu.
- Inverse agonists — samazina receptoru bāzes aktivitāti zem tā, kas novērojams bez liganda.
- Allostēriski modulātori — saistās citā vietā nekā galvenais ligands un maina tā afinitāti vai efektivitāti.
Ir svarīgi atšķirt afinitāti (cik labi ligands saistās) no efektivitātes vai eifijs (cik spēcīgi saistīšanās izsauc bioloģisku atbildi).
Ko tas nozīmē bioloģiski un medicīniski
Ligandu un receptoru mijiedarbības ir pamats hormonālām, neirotransmisijas, imūnām un metaboliskām atbildēm. Piemēri:
- Neirotransmiteri (piem., serotonīns, dopamīns) kā ligandi, kas ietekmē smadzeņu signālu pārvadi.
- Hormoni (piem., insulīns) kā ligandi, kas kontrolē vielmaiņu un šūnu funkcijas.
- Zāļu molekulas, kas spēj būt agonisti vai antagonisti — pamats farmakoloģijai un medikamentu dizainam.
Farmakoloģiskā optimizācija bieži cenšas palielināt afinitāti un specifiskumu, vienlaikus saglabājot labu drošības profilu un farmakokinētiku.
Mērīšanas metodes
- Virziensā: plūsmas sensoru metodes (SPR — surface plasmon resonance) — mēra asociācijas/disociācijas ātrumu reālā laikā.
- Termodinamika: ITC (izotermālā titrēšanas kalorimetrija) — nosaka saistīšanas entalpiju un afinitāti.
- Radioligandu saistīšanas testi — klasiskā metode receptoru afinitātes noteikšanai.
- Fluorescences un anizotropijas metodes, microscale thermophoresis, equilibrium dialysis u.c.
Ko vēl ņemt vērā
Saistīšanās bieži ir atgriezeniska un dinamiski regulēta. Pieaugot ligandu koncentrācijai, receptoru aizpildījums palielinās līdz noteiktam maksimumam. Dažos gadījumos receptoru kompleksi rādīs kooperativitāti (pozitīvu vai negatīvu), ko raksturo Hill koeficients.
Kopsavilkums: Ligandi ir dažādas dabas molekulas, kas saistās ar mērķa bioloģiskām molekulām, mainot to formu un funkciju. Saistīšanās pamatā ir starpmolekulāri spēki; tās stiprumu un laiku raksturo afinitāte un kinetika. Sapratne par ligand–receptor mijiedarbībām ir būtiska bioloģijā, farmakoloģijā un zāļu izstrādē.
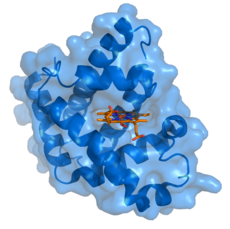
Mioglobīns (zils) ar piesaistītu ligandu hemu (oranžs).
Saistītās lapas
- Signālu pārvade
- Citokīns
- Agonists
- Receptoru antagonists
Meklēt