Molekula — definīcija, struktūra, īpašības un molekulārā formula
Uzzini, kas ir molekula: definīcija, atomu struktūra, fizikālās un ķīmiskās īpašības un molekulārā formula ar skaidriem piemēriem un ilustrācijām.
Molekula ir mazākais ķīmiskās vielas daudzums, kas var pastāvēt kā neatkarīga daļa bez ķīmiskas identitātes maiņas. Ja molekulu sadalītu mazākos gabaliņos, tie bieži kļūtu par citu vielu vai par atsevišķiem ķīmiskajiem elementiem; piemēram, sadalot ūdens molekulu, iegūst hidroksilgrupu un ūdeņraža atomu. Molekulas var būt ļoti vienkāršas (piem., divatomu gāzes) vai ļoti sarežģītas (piem., proteīni un citi makromolekuli).
Struktūra un ķīmiskās saites
Molekulas sastāv no atomiem, kas savienoti kopā noteiktā telpiskā izkārtojumā. Atomi savienojas galvenokārt ar kovalentajām saitēm, kur elektroni tiek kopīgota starp atomi, bet molekulas var veidoties arī ar koordinācijas saitēm vai kombinētām saiknēm. Sašu veids un garums nosaka molekulas ķīmiskās īpašības un formu.
Ne visas atomu kombinācijas ir vienlīdz iespējamas; veidojas konkrētas struktūras, jo atomi “dod priekšroku” noteiktiem saites veidiem un leņķiem. Turklāt tiem ir atšķirīgs valentīgums (spēja veidot noteiktu saišu skaitu). Piemēram, skābekļa atomiem parasti veidojas divas saites ar citiem atomiem, oglekļa atomiem parasti ir četras saites, bet slāpekļa atomiem parasti ir trīs saites. Ir arī izņēmumi (radikāļi, joni, koordinācijas savienojumi, paplašinātie valences apvalki u. c.).
Telpisko molekulas formu var prognozēt ar modeļiem, piemēram, VSEPR teoriju (elektronu pāru atgrūšanās), un to nosaka arī molekulāro orbitāļu sadalījums. Molekulārajā ķīmijā izmanto arī jēdzienu hibridizācija (sp, sp2, sp3 u. c.), lai aprakstītu, kā atomu orbitāļi pārkārtojas saišu veidošanai.
Saistenie tipi un starpmolekulārās mijiedarbības
- Kovalentās saites: elektronu koplietošana starp negatīvi noslogotiem atomi (polāras un nepolāras).
- Ionicitāte: ja elektrontransfers rezultātā rodas jonu pāris — šie savienojumi parasti neveido molekulas tādā nozīmē kā kovalenti savienojumi, bet gan joniskus kristālus.
- Metāliskās saites: brīvo elektronu jūra metālos — bieži apraksta metālu atomu organizāciju.
Starpmolekulārās mijiedarbības (kas neietver ķīmiskas saites starp atomiem molekulā) — piemēram, Londonas dispersijas spēki, dipola-dipola mijiedarbības un ūdeņraža saites — ietekmē šķīdību, kušanas/viršanas temperatūru un citus fizikālos parametrus.
Molekulas formas un ģeometrija
Molekulas var būt lineāras (piem., CO2), trigonkopiskas, tetraedriskas (piem., CH4), piramīdveida (piem., NH3) vai ļoti sarežģītas, asimetriskas. Molekulas ģeometrija nosaka daudzus fizikālos un ķīmiskos parametrus, tostarp polaritāti un reaktivitāti.
Molekulārā formula un tās veidi
Izmantojot molekulāro formulu, var pierakstīt visu molekulā esošo atomu skaitu. Piemēram, glikozes molekulārā formula ir C6H12O6. Tas nozīmē, ka viena glikozes molekula satur sešus oglekļa atomus, divpadsmit ūdeņraža atomus un sešus skābekļa atomus.
Pastāv vairāki formulas veidi:
- Molekulārā formula: norāda precīzu atomu skaitu katrā molekulā (piem., H2O, C6H12O6).
- Empīriskā formula: norāda atomu attiecību vienkāršākā veselajā skaitlī (piem., ūdeņraža peroksīdam H2O2 empīriskā formula ir HO).
- Strukturālā formula: rāda, kā atomi savienoti (var būt lineāra, rindota vai 2D shēma).
- Konstitucionālā (kondensētā) formula: parāda saites īsāk, piemēram, CH3CH2OH alkoholiem.
Molekulāro masu aprēķina summējot katra atoma relatīvo atommasu, un to izsaka atommasas vienībās (u) vai gramus uz molu (g·mol−1). Lai saistītu molekulāro skaitu ar masu, izmanto mola jēdzienu un Avogadro skaitli (~6.022·10^23 daļiņu/mol).
Fizikālās un ķīmiskās īpašības
Molekulas īpašības ir atkarīgas no to sastāva, formas un mijiedarbībām ar citām molekulām. Galvenie ietekmējošie faktori:
- Polarizācija un polaritāte: polāras molekulas (piem., H2O) šķīst polāros šķīdinātājos; nepolāras molekulas (piem., CCl4) šķīst nepolāros šķīdinātājos.
- Starpmolekulārās saites: ūdeņraža saites paaugstina kušanas un viršanas temperatūru (salīdzinājumā ar līdzīga izmēra molekulām bez ūdeņraža saišu).
- Reaktivitāte: atkarīga no saišu stipruma, elektronu blīvuma un funkcionālajām grupām.
Molekulas stāvokļi un kustība
Gāzu kinētiskajā teorijā ar terminu "molekula" bieži apzīmē jebkuru gāzveida daļiņu neatkarīgi no tās sastāva. Saskaņā ar šo definīciju cēlgāzu atomi tiek uzskatīti par molekulām, jo faktiski tie ir monoatomāras molekulas.
Gāzēs, piemēram, gaisā, molekulas kustas brīvi, triecoties viena pret otru; to kinētiskā enerģija nosaka temperatūru un spiedienu. Šķidrumos, piemēram, ūdenī, molekulas ir saistītas ar starpmolekulārajām mijiedarbībām, bet tās var mainīt pozīcijas (plūsma). Cietās vielās, piemēram, cukurā, molekulas parasti var tikai vibrēt ap savām līdzsvara pozīcijām; dažos cietvielu veidos (piem., molekulārie kristāli) molekulas tomēr var būt orientācijas brīvības. Katrā no stāvokļiem molekulām piemīt atšķirīgas termodinamiskas īpašības.
Ceturtajā vielas stāvoklī, ko sauc par plazmu, atomi ir jonizēti un parasti nespēj veidot stabilas molekulas, jo brīvie elektroni un joni pārtrauc parastās ķīmiskās saites.
Molekulu noteikšanas metodes
Molekulāro struktūru un sastāvu nosaka ar dažādām eksperimentālajām metodēm:
- Masu spektrometrija: nosaka molekulmasu un fragmentus.
- Rentgenstaru difrakcija (XRD): precīzi atklāj kristālisku molekulāru struktūru.
- Nukleārā magnētiskā rezonanse (NMR): sniedz informāciju par ķīmisko vidi un saikņu tipiem organiskajās molekulās.
- Infrasarkanā (IR) un Raman spektroskopija: identificē funkcionālās grupas pēc vibrāciju spektra.
Piemēri un īpaši gadījumi
Dažas labi pazīstamas molekulas: diatomiskā skābekļa molekula O2, slāpeklis N2, ogļskābā gāze CO2, ūdens H2O un glikoze C6H12O6. Ir arī makromolekulas (piem., polimēri, proteīni, DNS), kas sastāv no tūkstošiem vai miljoniem atomu un bieži veido sarežģītas trīsdimensiju struktūras ar specifiskām funkcijām dzīvajos organismos.
Molekulas loma dzīvē un tehnoloģijās
Molekulas ir pamats ķīmijai, bioloģijai un materiālzinātnei. No vienkāršām molekulām ražo enerģiju un veido celtniecības blokus; no kompleksām molekulām — zāles, polimērus, bioloģiskos makromolekulas un funkcionalizētus materiālus, kas izmantojami elektronikā, medicīnā un rūpniecībā.
Kopsavilkumā: molekula ir specifiska atomu kopuma struktūra ar noteiktām saišu attiecībām un telpisko formu; tās formulas, masa, forma un starpmolekulārās mijiedarbības nosaka molekulas fizikālās un ķīmiskās īpašības, izturību un funkcionalitāti.
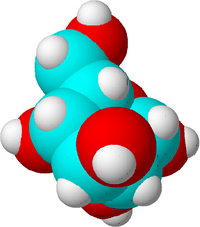
Tā ir cukura molekula. Oglekļa atomi ir zili, skābekļa atomi - sarkani, bet ūdeņraža atomi - balti, lai parādītu atšķirības. Patiesībā atomiem nav krāsas.
Saistīšana
Lai molekula varētu pastāvēt, atomiem ir jāsavienojas. Tas notiek, kad divi atomi dalās ar elektroniem. Tā vietā, lai riņķotu tikai ap vienu atomu, elektrons tagad riņķo ap diviem. To sauc par kovalento saiti. Dažreiz tiek dalīts vairāk nekā viens elektrons. Jo vairāk elektronu ir kopīgi, jo stiprāka kļūst saite un jo spēcīgāk atomi turas kopā.
Saiknes var arī izjaukt. Tā kā vairuma saišu veidošanai ir nepieciešama enerģija, tās arī izdala enerģiju, kad tās tiek pārrautas. Taču, pirms lielākā daļa saišu pārtrūkst, molekula ir jāsasilda. Tad atomi sāk kustēties, un, kad tie kustas pārāk daudz, saite pārtrūkst. Molekulas, kuru pārraušanai nepieciešams mazāk enerģijas, nekā tās izdala, kad tās tiek pārrautas, sauc par degvielām. Piemēram, svece vienkārši sēž, un nekas nenotiek. Bet, ja to aizdedzina ar sērkociņu, tā deg ilgi. Sērkociņš dod enerģiju, lai pārrautu pirmās saites, kas atbrīvo pietiekami daudz enerģijas, lai pārrautu zem tām esošās saites, līdz svece ir sadegusi.
Pastāv arī jonu saites.
Jautājumi un atbildes
J: Kas ir molekula?
A: Molekula ir mazākais iespējamais ķīmiskās vielas daudzums. To veido atomi, kas savā starpā savienoti noteiktā formā vai veidā.
J: Cik daudz saišu ir skābekļa, oglekļa un slāpekļa atomiem?
A: Skābekļa atomiem vienmēr ir divas saites ar citiem atomiem, oglekļa atomiem vienmēr ir četras saites ar citiem atomiem, bet slāpekļa atomiem vienmēr ir trīs saites ar citiem atomiem.
J: Ko par molekulām saka gāzu kinētiskā teorija?
Atbilstoši gāzu kinētiskajai teorijai terminu "molekula" bieži lieto visām gāzveida daļiņām neatkarīgi no to sastāva. Tas nozīmē, ka cēlo gāzu atomi tiek uzskatīti par molekulām, jo faktiski tie ir monatomāras molekulas.
J: Kā molekulas uzvedas dažādos stāvokļos?
A: Gāzēs, piemēram, gaisā, molekulas vienkārši lido apkārt. Šķidrumos, piemēram, ūdenī, molekulas ir saķērušās kopā, taču tās joprojām var kustēties. Cietās vielās, piemēram, cukurā, molekulas var tikai vibrēt. Plazmā (ceturtajā vielas stāvoklī) atomi ir jonizēti un nevar veidot molekulas.
J: Kāda ir molekulārā formula?
A: Molekulāro formulu izmanto, lai pierakstītu visu molekulā esošo atomu skaitu. Piemēram, C6H12O6 ir viena glikozes molekula, kas sastāv no sešiem oglekļa atomiem, divpadsmit ūdeņraža atomiem un sešiem skābekļa atomiem.
Meklēt