Ūdeņraža izotopi: protijs, deitērijs, tritijs — definīcija un īpašības
Uzziniet par ūdeņraža izotopiem — protiju, deitēriju un tritiju: definīcijas, īpašības, stabilitāte, radioaktivitāte un pielietojumi skaidri un saprotami.
Ūdeņradim ir trīs galvenie izotopi: procijs (1H), deitērijs (2H) un tritijs (3H). Šie izotopi dabā veidojas dabiski. Protijs un deitērijs ir stabili. Trītijs ir radioaktīvs, un tā pussabrukšanas periods ir aptuveni 12 gadi. Zinātnieki ir radījuši vēl četrus ūdeņraža izotopus (4H līdz7 H), taču šie izotopi ir ļoti nestabili un dabā neeksistē.
Galvenie ūdeņraža izotopi ir unikāli, jo tie ir vienīgie izotopi, kuriem ir nosaukums. Šie nosaukumi tiek lietoti arī mūsdienās. Deitērijam un tritijam dažkārt tiek piešķirti savi simboli - D un T. Tomēr Starptautiskajai teorētiskās un lietišķās ķīmijas savienībai šie nosaukumi ļoti nepatīk, lai gan tos bieži lieto. Ir arī citi izotopi, kuriem bija savi nosaukumi, kad zinātnieki pētīja radioaktivitāti. Taču mūsdienās to nosaukumus vairs neizmanto.
Piezīme par nosaukumu: latviešu valodā pareizā izrunas/ortogrāfijas forma ir protijs (parasti apzīmēts kā 1H). Šeit saglabāta oriģinālā saitē redzamā forma.
Kas ir izotopi un kā tie atšķiras
Izotopi ir tāda paša ķīmiskā elementa atomi, kuriem ir atšķirīgs neitronu skaits kodolā. Ūdeņraža gadījumā atomi satur vienu protonu (kas definē elementu), bet atšķiras pēc neitronu skaita:
- Protijs (1H): 1 protons, 0 neitronu. Visizplatītākais ūdeņraža veids.
- Deitērijs (2H vai D): 1 protons, 1 neitrons. Saukts arī par smago ūdeņradi.
- Tritijs (3H vai T): 1 protons, 2 neitroni. Radioaktīvs, beta‑izotops.
Dabiskā izplatība un rašanās
- Protijs veido lielāko daļu dabiskā ūdeņraža — aptuveni 99.98%.
- Deitērijs dabā sastopams nelielā daudzumā: aptuveni 0.015% (apmēram 150–160 daļas uz miljonu). Tas veido smago ūdeni (D2O), kas atšķiras fizikāli no parastā ūdens.
- Tritijs dabiskā veidā ir ārkārtīgi mazs; to rada kosmiskie stari atmosfērā un kodolreakcijās. Cilvēka darbības (kodolierīces, reaktori) palielina tā koncentrācijas.
- Izotopi 4H–7H tiek novēroti tikai laboratorijās kā īslaicīgas rezonanses vai ļoti neizlīdzinātas, ātri sabrūkošas dalītas stāvokļi — dabā tie neeksistē.
Fizikālās un ķīmiskās īpašības
Ķīmiski visi ūdeņraža izotopi uzrāda līdzīgu ķīmisko uzvedību, jo kopīga ir protonu skaita. Tomēr masu atšķirības ietekmē dažas fizikālās un ķīmiskās īpašības:
- Deitērija masa aptuveni dubultojas pret protiu, kas ietekmē vibrācijas frekvences, saites enerģijas un reakciju ātrumus — sauc par izotopa efektu (kinētiskais izotopa efekts).
- Smagais ūdens (D2O) ir blīvāks un tam ir augstāka kušanas un vārīšanās temperatūra nekā H2O (piemēram, D2O blīvums ~1.1056 g/cm³ pie 25 °C; kušanas temperatūra ~3.82 °C). Šīs atšķirības padara smago ūdeni noderīgu konkrētām tehniskām pielietojuma jomām.
- Tritija beta starojums ir zemas enerģijas (maks. ~18.6 keV), tāpēc ārējā starojuma risks ir salīdzinoši mazs, bet ja tritijs tiek uzņemts organismā (ūdenī), tas var radīt radiācijas iedarbību no iekšpuses.
- Nukleārais spins: protiam I = 1/2, deitērijam I = 1 (kvadrupola moments) un tritijam I = 1/2 — tas ietekmē magnētiskās rezonanses (NMR) īpašības.
Tehnoloģiskas un zinātniskas lietojumprogrammas
- Deitērijs (D) tiek plaši izmantots kā ķīmiskais marķieris (deutērēti savienojumi) organiskajā un bioķīmijā, NMR spektroskopijā, kā arī smagā ūdens izmantošanā kā moderatoru dažos kodolreaktoros.
- Tritijs (T) lieto kā radioaktīvu marķieri biofizikā un biomedicīnā, kā arī gaismas avotos (luminiscējošās ierīcēs). Tritijs ir vienlaikus nozīmīgs arī kodolfūzijas pētījumos (D–T fūzija ir viena no efektīvākajām fūzijas reakcijām).
- Protijs (1H) — pamata avots ķīmiskajām reakcijām un ūdens sastāvā; 1H NMR ir galvenā metode organiskajā strukturālajā analīzē.
Drošība, ražošana un uzraudzība
- Tritija drošība: kā zemas enerģijas beta avots tas neiziet cauri ādas slogu, bet bīstams var kļūt, ja nonāk organismā (caur dzeramo ūdeni, pārtiku, ieelpojot). Tāpēc vidi ar trītiju monitorē, it īpaši ap kodolobjektiem.
- Ražošana: tritiju galvenokārt iegūst kodolreaktoros un speciālos neitronu avotos no litija vai citiem materiāliem vai kā blakusprodukts kodolieroču izmēģinājumos un reaktoru ekspluatācijās. Deitēriju var iegūt destilējot vai elektrolizējot ūdeni, lai palielinātu D/H attiecību.
Kāpēc tas ir svarīgi
Ūdeņraža izotopi ir būtiski gan pamatzinātnē (kodolfizika, kvantu ķīmija), gan praktiskos pielietojumos — no medicīniskās pētniecības un vides monitoringa līdz kodolfūzija un enerģētikai. Izpratne par to īpašībām palīdz novērtēt to potenciālu un riskus, kā arī efektīvi izmantot specifiskos izotopus rūpniecībā un zinātnē.
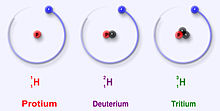
Trīs stabilākie ūdeņraža izotopi
Protijs (ūdeņradis-1)
Protijs ir visizplatītākais ūdeņraža izotops. Tas veido vairāk nekā 99,98 % no visa Visumā esošā ūdeņraža. To sauc par protu, jo tā kodolā ir tikai viens protons. Procija atommasa ir 1,00782504(7) u. Procija simbols ir 1H.Procija protons novērojumos nekad nav sadalījies, tāpēc zinātnieki uzskata, ka procijs ir stabils izotops. Jaunās daļiņu fizikas teorijas paredz, ka protons var sadalīties, taču šī sabrukšana ir ļoti lēna. Tiek uzskatīts, ka protonam ir 1036 gadu pussabrukšanas periods. Ja protonu sabrukšana ir taisnība, tad visi pārējie kodoli, par kuriem apgalvo, ka tie ir stabili, patiesībā ir tikai novērojami stabili, t. i., tie izskatās stabili. Nesenie eksperimenti ir parādījuši, ka, ja protonu sabrukšanas periods patiešām notiek, tad tā pusperiods ir 6,6 × 10 33gadi.
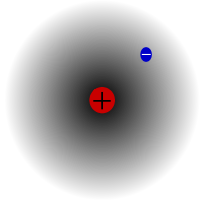
Protijs, visizplatītākais ūdeņraža izotops. Tas ir īpašs, jo ir vienīgais izotops, kuram nav neitrona.
Deitērijs (ūdeņradis-2)
Deitērijs jeb 2H vai dažreiz D ir vēl viens stabils ūdeņraža izotops. Izotopam ir viens protons un viens neitrons. Tas veido aptuveni 0,0026-0,0184 % no visiem ūdeņraža atomiem uz Zemes. Ūdeņraža gāzveida ūdeņradī uz Zemes ir mazāk, bet vairāk - jūras ūdenī (0,015 % jeb 150 ppm). Deitērijs nav radioaktīvs, un tas nekaitē dzīvām organismiem. Deitērijs var veidot arī ūdens molekulas. Ūdeni, kurā procija vietā ir deitērijs, sauc par smago ūdeni.
Tritijs (ūdeņradis-3)
Trītijs (3H) ir visstabilākais ūdeņraža radioizotops. Tas nozīmē, ka no visiem ūdeņraža radioaktīvajiem izotopiem tritijs ir vismazāk radioaktīvs. Tā kodolā ir viens protons un divi neitroni. Tritijs sadalās, izmantojot beta mīnus sabrukumu, un pārvēršas par hēliju-3. Tā pussabrukšanas periods ir 12,32 gadi.Trītijs veidojas dabiskā ceļā, atmosfēras augšējo slāņu gāzēm mijiedarbojoties ar kosmiskiem stariem. Tas rodas arī kodolieroču izmēģinājumu laikā. Tritiju un deiteriju izmanto D-T kodolsintēzē zvaigznēs, lai iegūtu daudz enerģijas.
Meklēt