Izotopi: definīcija, masas skaitlis un ķīmiskās īpašības
Izotopi: skaidra definīcija, masas skaitlis, neitronu loma un ietekme uz ķīmiskajām īpašībām — uzzini masas efektu un reaktivitātes atšķirības.
Ķīmiskā elementa atomi var pastāvēt dažādās formās — tos sauc par izotopiem. Izotopiem ir vienāds skaits protonu (un elektronu), bet atšķirīgs skaits neitronu. Tādēļ viena un tā paša elementa izotopi atšķiras pēc masas — to masas neatbilst viena otrai.
Masas skaitlis un atoma sastāvs
Masas skaitlis (parasti apzīmēts ar A) ir protonu un neitronu summa atomā. To var izteikt vienādojumā: A = Z + N, kur Z ir protonu skaits (atomnumurs), bet N ir neitronu skaits. Proti, ja zināms elementa atomnumurs un konkrētā izotopa masas skaitlis, var aprēķināt neitronu skaitu.
Atšķirībā no masas skaitļa, kas ir veselais skaitlis, atommasa (vai relatīvā atoma masa) ir vidējā vērtība, kas ņem vērā visu dabā sastopamo izotopu masas un to relatīvās abundances (sastopamības procentu). Piemēram, hloram ir divi galvenie izotopi 35Cl un 37Cl, un to relatīvā sastopamība nosaka hloru raksturojošo relatīvo atommasu.
Atoma elektroni un ķīmiskās īpašības
Neitrālā atomā elektronu skaits parasti sakrīt ar protonu skaitu. Tāpēc viena elementa izotopiem ir vienāda elektroniskā struktūra. Tā kā ķīmiskās reakcijas galvenokārt nosaka elektronu izvietojums, izotopi ķīmiski parasti izturas ļoti līdzīgi. Tomēr fiziskās īpašības, piemēram, masa un blīvums, var būt atšķirīgas.
Masas efekts un reakciju ātrums
Smagākiem izotopiem ķīmiskās reakcijas dažkārt norit lēnāk — šo parādību sauc par masas efektu vai kinetisko izotopu efektu. Tas ir izteiktāks viegliem elementiem; labi zināms piemērs ir ūdens izotopi:
- protijam (1H) — visvieglākais ūdeņraža izotops;
- deitērijam (2H) — masa aptuveni divreiz lielāka nekā procijam;
- tritijs (3H) — radioaktīvs, smagāks ūdeņraža izotops.
Vieglākiem elementiem masas attiecība starp izotopiem ir liela, tāpēc masas efekts ir pamanāmāks. Smagākiem elementiem relatīvā atommasu atšķirība parasti ir neliela, un ķīmiskā uzvedība praktiski nesakrīt.
Stabilie un radioaktīvie izotopi
Daži izotopi ir stabili — tie nemainās kodolā laika gaitā. Citi ir radioaktīvi (nestabili) un pašsabrūk, izstaro radiāciju un pārvēršas par citiem elementiem vai to izotopiem. Radioaktivitātei raksturīgs jēdziens — pusi noejas laiks (pusperiods), kas norāda laiku, pēc kura puse no sākotnējā daudzuma ir sabrukusi.
Praktiska nozīme un pielietojumi
Izotopiem ir daudz praktisku pielietojumu:
- arheoloģijā un ģeoloģijā: radiokarbona datēšana (14C) nosaka organisku materiālu vecumu;
- medicīnā: diagnostikā un terapijā izmanto radioaktīvos izotopus (piem., PET skenēšanai, radioķīmijai);
- pētījumi: izotopu marķieri (traceri) ļauj izsekot ķīmiskos ceļus un bioloģiskās vielmaiņas procesus;
- enerģētikā: kodolenerģijas ražošanā izmanto urāna un plutonija izotopus;
- rūpniecībā un zinātnē: izotopu attīrīšana, analīze un materiālu izpēte.
Vēl daži svarīgi jēdzieni
Izotopu sastopamība — procentuālā daļa, kādā konkrēts izotops sastopams dabā vai paraugā. Izotopiskā frakcionēšana — procesi, kas maina izotopu attiecību (piem., ķīmiskās vai fizikālās izdalīšanās laikā). Vidējā atommasa tiek aprēķināta, ņemot vērā visu izotopu masas un to relatīvās abundances.
Apkopojot: izotopi ir viena elementa atomu varianti ar vienādu protonu, bet atšķirīgu neitronu skaitu. Tas nosaka to masas skaitli, ietekmē fizikālās īpašības un dažkārt arī reakciju kinetiku, tomēr ķīmiskās īpašības lielākoties saglabājas līdzīgas.
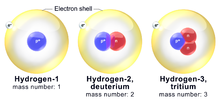
Ūdeņraža izotopi
Stabilitāte
Atomu kodolus veido protoni un neitroni, kurus kopā satur kodola spēks.Tā kā protoni ir pozitīvi lādēti, tie viens otru atgrūž. Neitrālie neitroni stabilizē kodolu. Tā kā tie atrodas kodolā, protoni ir nedaudz atgrūsti viens no otra. Tas samazina elektrostatisko pretestību starp protoniem. Tie joprojām iedarbojas ar pievilkšanas kodola spēku viens uz otru un uz protoniem. Lai divi vai vairāki protoni saistītos kodolā, ir nepieciešams viens vai vairāki neitroni. Palielinoties protonu skaitam, palielinās arī neitronu skaits, kas nepieciešams, lai kodols būtu stabils.
Dabā dažiem elementiem ir tikai viens izotops. Piemēram, fluors-19 (19F) ir vienīgais stabilais fluora izotops no vairākiem. Citiem elementiem ir daudz izotopu. Piemēram, ksenonam ir 9 izotopi. No 81 elementa, kam ir stabils izotops, lielākais stabilo izotopu skaits kādam elementam ir desmit (alvas elementam).
Daži izotopi ir radioaktīvi. Tos sauc par radioaktīvajiem izotopiem. Citi nav radioaktīvi. Tos sauc par stabiliem izotopiem.
Ūdeņradim ir trīs izplatīti izotopi. Visbiežāk sastopamais ūdeņraža izotops ir procijs (1H). Ūdeņraža atomu ar papildu neitronu (atommasa 2) sauc par deitēriju (2H). Ūdeņradi ar vienu protonu un diviem neitroniem (atoma masa 3) sauc par tritiju (3H). Procijs un deitērijs ir stabili izotopi, bet tritijs ir radioaktīvs izotops.
Visi smagākie periodiskās sistēmas elementi ir radioaktīvi. Visi radona, torija un urāna izotopi ir radioaktīvi, jo tie ir ļoti smagi. Tas ir tāpēc, ka atoma kodola spēkiem atoma kodolā ir grūti noturēt kopā visas daļiņas ar tik daudz protonu un neitronu.
Saistītās lapas
- Izotopu elektroķīmija
Jautājumi un atbildes
J: Kas ir izotopi?
A: Izotopi ir dažādi ķīmiskā elementa atomu veidi, kuriem ir ļoti līdzīga uzvedība, bet kuru svars ir atšķirīgs.
Q: Ar ko izotopi atšķiras viens no otra?
A: Viena elementa atomiem ir vienāds protonu skaits, bet dažādiem izotopiem ir atšķirīgs neitronu skaits. Tāpēc tiem ir arī atšķirīgi masas skaitļi, kas ir protonu skaits plus neitronu skaits.
Vai visi izotopi ir stabili?
A: Nē, daži izotopi nav stabili, tāpēc radioaktīvās sabrukšanas procesā tie pārvēršas par citu izotopu vai elementu. Šos izotopus sauc par radioaktīvajiem izotopiem, bet citus, kas nav radioaktīvi, sauc par stabiliem izotopiem.
J: Kā var identificēt izotopu?
A: Izotops parasti tiek nosaukts, norādot elementu un tā masas numuru. Piemēram, ogleklis-12 jeb 12C ir atoms ar 6 protoniem un 6 neitroniem, bet ogleklim-14 jeb 14C ir 8 neitroni.
J: Ko nozīmē "izotops"?
A: Vārds "izotops" nozīmē "vienā un tajā pašā vietā", norādot uz to, ka visi viena un tā paša elementa atomi periodiskajā tabulā atrodas vienā un tajā pašā vietā.
J: Kāpēc atomi ar vairāk neitroniem sver vairāk nekā atomi ar mazāk neitroniem?
A: Atomi ar vairāk neitroniem sver vairāk, jo tajos ir papildu daļiņas (neitroni), kas palielina to kopējo masu, salīdzinot ar atomiem ar mazāk neitroniem.
Meklēt