Vientuļie elektronu pāri: definīcija, īpašības un loma molekulās
Uzzini, kas ir vientuļie elektronu pāri: definīcija, īpašības un to loma molekulu formēšanā, reaktivitātē un nukleofilijā — skaidri un praktiski.
Vientuļais pāris ir divu elektronu grupa, kas netiek izmantota nevienā no atomu savstarpējām saitēm. Tie atrodas atoma pēdējā čaulā — valences čaulā — un kopā ar saitēs izmantotajiem elektroniem veido kopējo valences elektronu skaitu. Vientuļie pāri parasti ir ne-saistoši (nonbonding) elektroni, un to enerģija parasti ir augstāka nekā saišu elektroniem, jo tie nekonkrēti dalās starp diviem atomiem. Tomēr to enerģija var būt zemāka nekā antibondīgajiem orbitaliem.
Īpašības
- Skaits un izvietojums: viens atoms var turēt vienu, divus vai vairāk vientuļos pārus atkarībā no tā elektroniskā stāvokļa (piem., skābeklim ūdenī ir divi vientuļie pāri, slāpekļa amonjā — viens).
- Telpiskā prasība: vientuļie pāri aizņem vairāk vietas ap atomu nekā saistošie elektronu pāri, jo tie koncentrēti atrodas tuvāk atoma kodolam un rada lielāku atgrūšanos pret citiem elektronu pāriem.
- Enerģētiskās īpašības: nonbonding elektroni bieži ir vieglāk pieejami ķīmiskām reakcijām (piem., uzbrukumam elektrofilam) un var iesaistīties elektroniskajos pārejās (piem., n→π* pārejas UV/vis spektroskopijā).
- Polarizējamība un hidrogena saites: vientuļie pāri var radīt dipolus un darboties kā hidrogena saites akceptori (piem., skābekļa lone pair ūdenī vai slāpekļa lone pair amīnās).
Ietekme uz molekulas formu (VSEPR)
Vientuļajiem pāriem ir būtiska loma molekulārajā ģeometrijā. Saskaņā ar elektronu pāru atgrūšanās principu (VSEPR) vientuļie pāri atgrūžas spēcīgāk nekā saistošie elektronu pāri, tādēļ tie samazina saitē esošo elektronu pāru leņķus. Piemēri:
- Ūdens (H2O): divi vientuļie pāri uz skābekļa samazina H–O–H leņķi līdz aptuveni 104,5° (salīdzinājumā ar tetraedrisku 109,5°).
- Amonjaks (NH3): viens vientuļais pāris rada H–N–H leņķi aptuveni 107°.
Ir arī gadījumi, kad vientuļie pāri var būt stereohĒmiski aktīvi vai neaktīvi (piem., inert pair effect smagākiem p‑bloku elementiem), kas ietekmē molekulas formu un ķīmiskās īpašības.
Reaktivitāte — nukleofili, bāzes un koordinācijas saites
Vientuļie pāri bieži darbojas kā elektronu donori. Tie padara atomu vai molekulu par nukleofilu vai Lewis bāzi, kas var uzbrukt elektrofilam vai veidot koordinētu (koordinācijas) kovalento saiti. Raugosies:
- Nukleofiliskums: atkarīgs no lone pair pieejamības — ietekmē elektronegatīvums, hibridizācija, steriskā bloķēšana un solvatācija. Piemēram, ūdens un amonjaks ir mēreni nukleofili, bet hidroksīds vai tiols var būt spēcīgāki.
- Resonanses delokalizācija: vientuļie pāri var delokalizēties uz blakus pi‑sistēmām (piem., amīna lone pair un karbonilgrupa amīdos), samazinot to reaktivitāti un ietekmējot p‑sajaukumu, bāziskumu un savstarpējo polaritāti.
- Koordinējošā spēja: metālu kompleksos lone pair veido koordinētās saites, piemēram, NH3 vai H2O ligandu gadījumā.
Elektroniskā struktūra un ķīmiskā zīmēšana
Levisa struktūrās vientuļie pāri attēlo kā punktus vai pārus punktu ap atomu. Lai pareizi uzzīmētu struktūru, svarīgi ir:
- saskaitīt visus valences elektronus,
- izveidot nepieciešamās saites,
- izdalīt pārējos elektronus kā vientuļos pārus tā, lai pēc iespējas atomiem būtu pilns elektroniskais apvalks (okteta princips), ņemot vērā izņēmumus — paplašināts oktets vai nepāra skaita elektroni.
Arī formālais lādiņš aprēķināšana palīdz noteikt optimālo izvietojumu un lone pair sadalījumu. Dažkārt lone pair delokalizācija (rezonanse) samazina formālo lādiņu uz konkrēta atoma.
Praktiski piemēri un nozīme
- Ūdens molekulā skābeklim ir divi vientuļie pāri — tie nodrošina ūdens polāro raksturu un spēju veidot hidrogena saites, kas ir svarīgas šūnu bioloģijā, šķīdībai u.c.
- Slāpeklim amonjā ir viens vientuļais pāris, kas padara NH3 par labu ligandu metālu kompleksos un mēreni spēcīgu bāzi.
- Halogēni (F, Cl, Br, I) parasti satur trīs vientuļos pārus; tie bieži darbojas kā nukleofili vai hidrogena saites akceptori.
- Organiskajā ķīmijā lone pair loma ir būtiska reakciju mehānikā — tie veicina nucleofiliskus uzbrukumus, kondensācijas reakcijas, katalīzi un elektronu pārejas (piem., n→π*).
Kopsavilkumā, vientuļie elektronu pāri ir neatņemama atomu un molekulu uzvedības daļa: tie nosaka molekulas formu, reaktivitāti, spēju veidot saites un mijiedarbības ar citiem ķīmiskiem objektiem. Sapratne par lone pair īpašībām palīdz paredzēt molekulārās ģeometrijas, reakciju ceļus un materiālu īpašības.
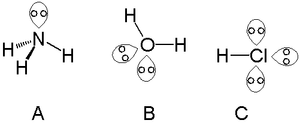
vientuļie pāri amonjakā (A), ūdenī (B) un sālsskābē (C)
Meklēt