Elektrofils: definīcija, īpašības un piemēri organiskajā ķīmijā
Elektrofils: skaidra definīcija, galvenās īpašības un organiskās ķīmijas piemēri (HCl, karbonili, oksidētāji), reakciju mehānismi un nukleofīlu uzbrukumi.
Ķīmijā elektrofils ir molekula vai atoms, kas labprāt uzņem elektronus no citas molekulas vai atoma. Daudziem elektrofīliem ir pozitīvs lādiņš. Tos sauc arī par Lūisa skābēm. Daži elektrofilu piemēri ir molekulas, kuru atomu elektronegativitātes atšķirības ir lielas, piemēram, HCl vai karbonils, kā arī oksidētāji. Elektrofils var būt gan neitrāla daļiņa (piem., polarizēta halogēna molekula), gan daļēji vai pilnībā pozitīvi lādēta suga (piem., H+, karbocations).
Kas raksturo elektrofīlus
Elektrofilu spēju pieņemt elektronus nosaka vairāki faktori:
- Elektriskais lādiņš: pozitīvi lādētas sugas (piem., H+, karbocations) vieglāk pievelk elektronus.
- Elektronu slāpes un tukšas orbitālas: spēja pieņemt pāru elektronu Saistošajā orbitālā (piem., tukša p-orbitāla pie karbocationa vai acceptorā) palielina elektrofīlismu.
- Induktīvie un mesomērie efekti: elektronu atvilkšana ar -I grupām vai resonanses stabilizācija, kas palielina pozitīvo raksturu noteiktā atoma (piem., karbonilkarbona atomā), padara to labāku elektrofīlu.
- Polarizācija: molekulas, kurās saites ir polarizētas (piem., halogēnu pāri ar AlCl3 katalizatoru), var uzvesties kā elektrofili reaktīvos apstākļos.
- HSAB princips (mīkstie / cietie elektrofili): daļiņas ar lielu polarizējamību ir „mīkstas”, bet mazāk polarizējamās ar augstu pozitīvo blīvumu — „cietas”; tas ietekmē, kuri nukleofili tiks izvēlēti reakcijās.
Piemēri organiskajā ķīmijā
- Protonu donors: HCl un citi skābie protoni — spēj pieņemt elektronus pēc to pārvietošanas uz nukleofilu.
- Karbonilgrupas karbonilkarbona atomā: karbonils (aldehīdi, ketoni) — C=O atoma C daļēji pozitīvais raksturs padara to par biežu elektrofīlu nukleofilai pievienošanai.
- Nitronija jons: NO2+ ir spēcīgs elektrofils, kas iesaistās elektrofilā aromātiskā substitūcija reakcijās (nitrēšana).
- Karbocations: reakciju starpprodukti ar pozitīvu oglekļa centru, ļoti reaktīvi elektrofili.
- Polarizētas halogēnu molekulas: Br2 vai Cl2 var kļūt elektrofilas, ja tās polarizē ar metāla halogenīdu katalizatoru (piem., FeBr3), kas ļauj halogēna atomam uzbrukt pi-sistēmai.
- Lewis skābes: piemēram, BF3, AlCl3 — šīs sugas pieņem elektronu pāri un darbojas kā elektrofili katalītiskās sistēmās.
- Oksidētāji: dažkārt oksidētāji uzvedas kā elektrofili, jo pieņem elektronus no substrāta (piem., KMnO4, CrO3 redoksprocesos).
Elektrofīla reakcijas loma un mehānismi
Elektrofili ir galvenie reaģenti daudzās organiskās reakcijās:
- Elektrofilā adīcija: pie alkēniem un alkīniem — elektrofilais uzbrūk pi-saitei, veidojot starpproduktu, kuru pēc tam atklāj nukleofils.
- Elektrofilā aromātiskā substitūcija: aromātiskā gredzena oglekļiem uzbrūk elektrofils (piem., nitrēšana, sulfoļošana, halogenēšana ar katalizatoru), pēc tam atjaunojas aromātiskums, atbrīvojot protonu vai kompleksu.
- Nukleofilā adīcija pie karboniliem: karbonilskābi saturošie atomu centri ir elektrofili, jo oksigēns pievelk elektronus; nukleofils pievienojas C atomam, veidojot adiču.
Kā novērtēt, cik labs ir elektrofils
Elektrofīla "labs/reaktīvs" raksturs atkarīgs no:
- elektriskā lādiņa un elektroniskās vides;
- substituentu efektiem (elektronu atvilkšana palielina elektrofīlismu);
- spējas stabilizēt vai destabilizēt starpproduktus (piem., rezonanšu stabilizācija samazina vēlmi papildu reakcijām);
- solventu un katalizatoru klātbūtnes — daudzi elektrofili tiek aktivēti ar Lewis skābēm vai polarajiem šķīdinātājiem.
Kopsavilkums
Elektrofils ir suga, kas meklē elektronus vai elektronu pārus. To darbība organiskajās reakcijās ir centrāla — elektrofils uzbrūk nukleofilam, veidojot jaunas saites un starpproduktus. Izpratne par to, kas palielina vai samazina elektrofīlismu (lādiņš, inducējošie grupējumi, polarizācija, katalizatori), palīdz paredzēt reakciju kursu un kontrolēt organiskās sintezēs izmantotos apstākļus.
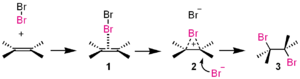
Šajā pievienošanas reakcijā broms (Br2 ) ir elektrofils.
Jautājumi un atbildes
J: Kas ir elektrofils?
A: Elektrofils ir molekula vai atoms, kas labprāt uzņem elektronus no citas molekulas vai atoma.
J: Kāpēc elektrofīlus sauc arī par Lūisa skābēm?
A: Par elektrofīliem sauc arī Lūisa skābes, jo tie var pieņemt elektronu pārus no citām molekulām.
J: Kādi ir daži piemēri par elektrofīliem?
A: Daži elektrofilu piemēri ir molekulas, kuru atomu elektronegativitāte ir ļoti atšķirīga, piemēram, HCl vai karbonils, kā arī oksidētāji.
J: Kā nukleofili reaģē ar elektrofīliem?
A: Nukleofili reaģē ar elektrofīliem, uzbrūkot tiem.
J: Kas ir nukleofils?
A: Nukleofils ir pretēja veida molekula elektrofilam. Tā ir molekula vai atoms, kas labprāt ziedo elektronus.
J: Kā notiek pievienošanas reakcijas starp elektrofīliem un nukleofīliem?
A: Aditīvās reakcijas notiek starp elektrofīliem un nukleofīliem, kad nukleofils uzbrūk elektrofilam, veidojot jaunu saiti.
J: Vai elektrofilam var būt negatīvs lādiņš?
A.: Elektrofilam var būt pozitīvs lādiņš, bet tam var būt arī daļējs pozitīvs lādiņš vai tā var nebūt vispār. Galvenā īpašība ir tā, ka tas ir gatavs pieņemt elektronus.
Meklēt