Karbonils (C=O): definīcija, īpašības un reakcijas
Karbonils (C=O): definīcija, īpašības un reakcijas — uzzini struktūru, reaktivitāti, nukleofīlos piejaukumus, redoksprocesus un analītiskās metodes.
Karbonils ir C=O grupa molekulā. Tā sastāv no oglekļa un skābekļa atoma, kas savienoti ar dubulto saiti. Ogleklim karbonila grupā parasti ir vēl divas saites, kas var būt ar dažādām organiskām vai neorganiskām grupām; tāpēc karbonils veido daļu no dažādām funkcionālajām grupām, piemēram, ketona, aldehīda, estera, amīda vai skābes atvasinājumiem.
Elektrostatiskās un elektroniskās īpašības
Skābeklis ir vairāk elektronegatīvs par oglekli, tādēļ kopīgajās saitēs elektroni ir vairāk pārvietoti uz skābekli. Rezultātā skābeklis nēsā daļēju negatīvu lādiņu (δ–), bet ogleklis — daļēju pozitīvu lādiņu (δ+). Tāpēc karbonila ogleklis ir elektrofīls un viegli pakļaujas nukleofīlam uzbrukumam, savukārt skābeklis ir bieži protonācijas vai koordinācijas vieta (piem., ar skābiem katalizatoriem vai metālu jonām).
Ablīdzinājumā abas atoms cenšas sp2 hibridizēties, un karbonila grupa parasti ir planāra. Ir arī rezonanses iespējas: var uzzīmēt formu ar negatīvu lādiņu uz skābekli un pozitīvu uz oglekļa, kas skaidro oglekļa elektrofīlās īpašības.
Galvenās ķīmiskās īpašības
- Polarizācija: C=O ir spēcīgi polāra grupa ar lielu dipola momentu.
- Reaktivitātes secība akila centriem: dažādi acilgrupas atvasinājumi atšķiras pēc elektrofīluma — acilhlorīdi > anhidrīdi > esteri > amīdi (acilhalogenīdi ir visreaktīvākie).
- Ķīmiskā stabilitāte: karbonila dubultā saite ir stipra, bet to ietekmē konjugācija (piem., ar aromātu vai alkenu) un elektronasniegšanas vai atņemšanas grupas, kas var pazemināt vai paaugstināt reaktivitāti.
Biežākās reakcijas
Karbonili piedalās ļoti daudzveidīgās reakcijās. Galvenās grupas:
- Nukleofīla pievienošanās — aromorfiem aldehīdiem un ketoniem nukleofīls uzbrūk karbonila ogleklim, veidojot hemiacetalus/hemiacetālus, alkoholu pēc reducēšanas vai citu pievienotās grupas produktu.
- Imīnu veidošana — aldehīdi un ketoni reaģē ar primārajām amīnām, veidojot šauras ķēdes imīnus (šelfus) ar ūdens atdalīšanos.
- Hidrāta (gem-diole) veidošanās — daži karbonili viegli reaģē ar ūdeni, veidojot gem-diolus; šī reakcija ir atkarīga no elektrofilitātes un steriskā aizsargājuma.
- Enolizācija un enolāti — alfa-hidrogeni pie karbonila ir skābi; skābā vai bāziskā katalīzē veidojas enoli vai enolāti, kas piedalās alkilēšanā, aldola kondensācijās un citās C–C veidošanas reakcijās.
- Oxidēšana un reducēšana — aldehīdus viegli oksidē līdz karbonskābēm; karbonilus var reducēt uz alkoholiem (piem., ar LiAlH4 vai NaBH4).
- Acila pārneses reakcijas — esteri, amīdi un anhidrīdi var piedalīties acilēšanas vai transesterifikācijas reakcijās, kas ir svarīgas organiskajā sintēzē un polimēru ražošanā.
Spektroskopiska noteikšana
Karbonils ir ļoti atpazīstams ar dažādām spektroskopiskām metodēm:
- Infrasarkanā (IR) spektroskopija: C=O stretching parasti dod spēcīgu absorbciju apmēram 1700 cm–1. Precīzs maksimums mainās atkarībā no grupas: ketoni ap ~1715–1725 cm–1, esteri ~1735–1750 cm–1, amīdi ~1650–1690 cm–1, konjugācija pazemina frekvenci.
- 13C NMR: karbonila oglekļa signāls parasti atrodas ļoti augstos ķīmiskajos nobīdes laukos — aptuveni 160–220 ppm atkarībā no karbonila tipa (ketoni bieži ap ~200 ppm, esteri un amīdi zemāk).
- 1H NMR: aldehīdu protoni parasti parādās ~9–10 ppm; alfa-protoni (pie C–C(=O)) bieži ir 2–3 ppm.
- Mases spektrometrija: karboniliem raksturīgas noteiktas fragmentācijas ceļas (piem., McLafferty pārvietošana), kas palīdz noteikt struktūru.
Karbonilu loma dabā un pielietojumi
Karbonili ir plaši izplatīti dabā un rūpniecībā. Tie ir sastopami šādos kontekstos:
- Bioloģiskās molekulās — piemēram, ketoni un aldehīdi cukuros, piruvāts (metabolisms), steroīdi un daudzi koenzīmi satur karbonila grupas.
- Medikamentos un farmācijas sintēzē — karbonilu funkcijas ir pamats daudzām zālēm un sintēzes starpproduktiem.
- Rūpnieciskos polimeros — esteri un amīdi (karbonila atvasinājumi) veido poliesterus un poliamīdus (piem., nailonu), kas ir svarīgi materiāli.
- Parfimērijā un pārtikā — daudzi aromātiskie un garšas savienojumi satur aldehīdus vai ketonus.
Drošība un ķīmiskā aprūpe
Daži karbonila savienojumi ir kairinoši vai toksiski (piem., acilhlorīdi, daži aldehīdi). Darbojoties ar spēcīgi reaktīviem karboniliem, jāievēro standarta ķīmiskās drošības pasākumi: ventilācija, aizsargbrilles, cimdi un pareiza šķīdinātāju izmantošana. Reaģentu uzglabāšana un utilizācija jāveic saskaņā ar drošības datu lapām.
Kopsavilkumā, karbonils (C=O) ir centrāla un ļoti reaktīva funkcionālā grupa organiskajā ķīmijā — to raksturo polaritāte, spēja piedalīties nukleofīlās pievienošanās un acila pārneses reakcijās, kā arī viegli noteikt ar spektrālajām metodēm.
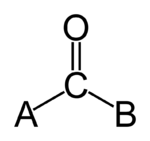
Karbonilgrupa
Jautājumi un atbildes
J: Kas ir karbonils?
A: Karbonils ir grupa molekulā, kas sastāv no oglekļa un skābekļa atoma ar dubulto saiti starp tiem.
J: Kādas ir divas citas saites, ko ogleklis var veidot karbonilā?
A: Karbonilā ogleklis var veidot vēl divas saites, kas var būt ar jebkuru citu grupu.
J: Kurš atoms karbonilā piesaistīs protonu skābē?
A: Skābē skābekļa atoms karbonilā piesaistīs protonu.
J: Kā ogleklis un skābeklis karbonilgrupā ir hibridizēti?
A: Gan oglekļa, gan skābekļa atomi karbonilgrupā ir sp2 hibridizēti.
J: Kāpēc karbonilgrupa ir svarīga funkcionālā grupa ķīmijā?
A: Karbonilgrupa ir svarīga funkcionālā grupa ķīmijā, jo ķīmiķi ar to var veikt daudzas reakcijas, tostarp gan nukleofīlas pievienošanas reakcijas, lai palielinātu molekulu, gan redoks reakcijas, lai veidotu alkoholu.
J: Kur var atrast karbonilus?
A: Karbonilus var atrast daudzās dabiskās vielās, narkotikās un medikamentos.
J: Kā var viegli pārbaudīt, vai molekula satur karbonilu?
A: To, vai molekulā ir karbonils, var viegli pārbaudīt, izmantojot infrasarkano spektroskopiju, kas dod spēcīgu signālu, vai oglekļa NMR spektroskopiju, kurā signāls parasti ir ļoti augstā frekvencē, tālu no daudziem citiem maksimumiem.
Meklēt