Enols (enoli): definīcija, īpašības un reakcijas organiskajā ķīmijā
Enoli (enols): definīcija, īpašības, enolāti, tautomerija, aldolreakcijas un kinētisko vs termodinamisko enolātu loma organiskajā ķīmijā.
Enols ir alķēns, kura dubultās saites vienā galā ir pievienota OH grupa. Viņu vispārīgā strukturālā forma ir R2C=CR'–OH (vai RCH=CR'–OH). To sauc par enolātu, ja skābekļa atomam ir atņemts protons (veidojas R2C=CR'–O−), proti — enolam deprotonējoties rodas anions, kas pazīstams kā enolāts vai enolāta jonis.
Tautomerija un termodinamika
Enoli bieži eksistē kā ketonu vai aldehīdu tautomēri. Tautomēri ir molekulas, kas atšķiras tikai ar ūdeņraža atoma novietojumu; tipisks piemērs ir keto–enol tautomērija, kur keto forma (C=O) parasti ir termodinamiski stabilāka nekā enol forma, jo skābekļa un oglekļa dubultā saite (C=O) ir stiprāka un enerģētiski izdevīgāka nekā C=C saite ar OH pievienojumu.
Tomēr enolu stabilitāti var būtiski ietekmēt faktori, piemēram, konjugācija (piem., ar aromātisku sistēmu), intramolekulāra ūdens saite vai iekšēja H-saite (piem., beta-diketonos), kas var novest pie enola dominances vai fluida līdzsvara.
Enolu ražošana un enolātu veidošana
Enolus var viegli iegūt no ketoniem vai aldehīdiem gan skābes, gan bāzes katalizētos procesos:
- Skābes katalizēta enolizācija: protonēšana pie karbonila skābekļa seko ar ūdeņraža pārnešanu uz α-oglekli.
- Bāzes katalizēta enolizācija: bāze atņem α-ūdeņraža, veidojot enolātu (skābekļa deprotonēšana vai oglekļa anions) — bieži ātrāka un selektīvāka ar spēcīgām bāzēm.
Enolāti tiek iegūti ar stiprām bases, piemēram, LDA (litijs diizopropilamīds) vai butillitija, īpaši anhidros apstākļos. Enolāti var arī aizsargāt kā silylietera atvasinājumus (piem., TMS-enolāti), kas ir noderīgi selektīvai C-alkilēšanai vai citām reakcijām.
Kinetiskie un termodinamiskie enolāti
Ketonu enolus var izgatavot no divām dažādām pusēm (no katras α-pozīcijas). Ir svarīgi spēt izvēlēties, kurā pusē reaģēt. Vieglāk reaģēt ir ar pusi, kurā ir mazāk aizvietotāju: to var iegūt zemā temperatūrā ar lielgabarīta bāzi. To sauc par kinētisko enolātu. Kinētiskais ceļš favorizē ātrāko, nesarežģītāko deprotonēšanu — parasti mazāk steriski aizsargāto hidrogēnu.
Otra puse ar vairāk aizvietotājiem ir grūtāk reaģējama un bieži prasa augstāku temperatūru vai mazāku, neapgrūtinošu bāzi, kas ļauj sasniegt līdzsvaru. Šādu enolātu sauc par termodinamisko enolātu, jo tas ir stabilāks (biežāk vairāk substitūts pie alkena, labāka konjugācija).
Biežākās reakcijas, kurās iesaistās enoli un enolāti
Enoli un enolāti ir ļoti reaktīvi intermediāti organiskajā sintēzē. Dažas no svarīgākajām reakcijām:
- Aldolreakcija — enolāts vai enols reaģē ar karbonilu, veidojot β‑hidroksi karbonilu (aldehīdu vai ketonu kondensācija). Aldolakondensācija novērš ūdeni un veido α,β‑nenodzīvējošu saiti.
- Alfa-halogenēšana — enoli reaģē ar halogēniem (Cl2, Br2), halogēns pievienojas α‑pozīcijā.
- Michael pievienošana — enolāti kā nukleofili pievienojas pie konjugētiem alkeniem (1,4‑adīcija).
- C‑alkilēšana vs O‑alkilēšana — enolāti var alkilēties pie oglekļa (C‑alkilēšana) vai pie skābekļa (O‑alkilēšana), un izvēle bieži atkarīga no metodes, katalizatora un enolāta tipa.
- Enolu ēteri un silyl enolāti — aizsardzība un selektīva manipulācija ar enoliem, kas ļauj veikt cita veida reakcijas bez nepatīkamas pašreakcijas.
Faktori, kas ietekmē enola stabilitāti un reaktivitāti
- Konjugācija ar π-sistēmām vai aromātiem palielina enola stabilitāti.
- Intramolekulāra H‑sauga (piem., β‑diketonos) var ievērojami stabilizēt enola formu.
- Elektronu atņemjoši vai donējoši aizvietotāji α‑pozīcijās maina deprotonācijas vieglumu un enola reaktivitāti.
- Stereķīmija un steriskā aizsardzība nosaka, kura puse būs kinētiski pieejama deprotonācijai.
Analīze un noteikšana
Enolus un enolātu klātbūtni var noteikt ar vairākām spektroskopiskām metodēm:
- IR spektroskopijā parādās O–H stiepes josla aptuveni 3200–3600 cm−1 (atkarībā no H‑saistēmēm), un C=C stiepšanās signāli.
- NMR: vinila protoni parasti parādās pie nosacīti augstiem ķīmiskajiem nobīdes, bet enola OH protons ir apmaiņā ar protolīzi (var būt plata signāla vai pazust deuterētā šķīdinātājā). 13C NMR atšķir oglekļus enolā un karbonilos.
- UV‑Vis spektri var liecināt par konjugātiem enoliem.
Praktiski padomi un pielietojums
Plānojot reakcijas, kurās iesaistīti enoli/enolāti, svarīgi izvēlēties atbilstošu bāzi, temperatūru un šķīdinātāju, lai kontrolētu selektivitāti (kinētiska vs termodinamiska) un izvairītos no blakusreakcijām (piem., polimerizācijas vai pārhalogenēšanas). Enolāti ir pamatā daudziem organiskiem sintēzes metodēm un tiek plaši izmantoti farmācijā, agroķīmijā un materiālzinātnē.
Galu galā, lai gan C=C + OH struktūra ir bieži mazāk stabila nekā karbonils, enoli un to enolāti ir ārkārtīgi noderīgi starpposmi un reagenti racionālai organiskajai sintēzei.
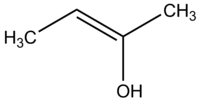
Enol
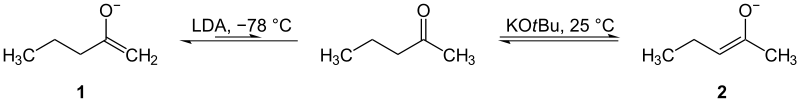
Kinētiskie (1) un termodinamiskie (2) enolāti
Jautājumi un atbildes
J: Kas ir enols?
A: Enols ir alķēns ar OH grupu, kas pievienota dubultās saites vienam galam.
J: Kas ir enolāts?
A: Enolāts ir enols ar atdalītu protonu skābekļa atomā.
J: Kas ir tautomēri?
A: Tautomēri ir molekulas, kas atšķiras tikai ar ūdeņraža atoma novietojumu.
J: Kā no ketoniem vai aldehīdiem var iegūt enolus?
A: No ketoniem vai aldehīdiem, izmantojot bāzi, var viegli iegūt enolus.
J: Kāpēc enoli ir nestabili?
A. Enoli ir nestabili, jo C=O saite ir stiprāka par C=C saiti.
J: Kas ir aldola reakcija?
A: Aldolreakcija ir interesanta reakcija, ko var veikt ar enoliem.
J: Kā reakcijai var izmantot enola pusi, kurā ir mazāk aizvietotāju?
A: Enola pusi ar mazāku aizvietotāju skaitu, ko sauc par kinētisko enolātu, reakcijai var izveidot zemā temperatūrā ar lielgabarīta bāzi.
Meklēt