Proteīnu salocīšanās — definīcija, posmi un slimību nozīme
Proteīnu salocīšanās — definīcija, posmi un slimību nozīme: uzzini, kā veidojas struktūras, kā kļūdas izraisa slimības un kā tas ietekmē toksicitāti.
Olbaltumvielu locīšanās ir process, kurā olbaltumvielas iegūst savu funkcionālo formu jeb "konformāciju". Tas galvenokārt ir pašorganizējošs process. Sākot no nejaušas spirāles, polipeptīdi salokās sev raksturīgajā darba formā. Struktūru kopā satur ūdeņraža saites.
Posmi ir šādi:
- Katrs proteīns pastāv kā nesalocīts polipeptīds vai nejaušs spirāle, kad no mRNS sekvences tiek tulkots lineārā aminoskābju ķēdē. Šim polipeptīdam nav attīstītas trīsdimensiju struktūras (augšējā attēla kreisā puse).
- Aminoskābes mijiedarbojas viena ar otru, veidojot labi definētu trīsdimensiju struktūru - salocītu olbaltumvielu (attēlā pa labi). To sauc par dabisko stāvokli. Iegūto trīsdimensiju struktūru nosaka aminoskābju secība (Anfinsena dogma).
Bez pareizas trīsdimensiju struktūras proteīns nedarbojas. Tomēr dažas olbaltumvielu daļas var nesalocīties: tas ir normāli.
Ja olbaltumvielas nesalokās savā dabiskajā formā, tās ir neaktīvas un parasti ir toksiskas. Tiek uzskatīts, ka vairākas slimības rodas nepareizi saliktu olbaltumvielu dēļ. Daudzas alerģijas izraisa olbaltumvielu salocīšanās, jo imūnsistēma neražo antivielas visām iespējamām olbaltumvielu struktūrām.
Kādi spēki stabilizē olbaltumvielu struktūras
Proteīnu galvenās stabilizējošās mijiedarbības ir:
- Ūdeņraža saites starp peptīdskābes grupām un sānu ķēdēm.
- Hidrofobiska mijiedarbība, kas noved pie hidrofobisko aminoskābju noritēšanas uz proteīna iekšpusi.
- Joniskas (elektrostatiska) mijiedarbība (soļi un sānu ķēžu soli).
- Disulfīda tilti (kovalentas saišu starp cisteīna atlikumiem), īpaši izkliedētām ekstracelulārajām olbaltumvielām.
- Van der Waals spēki, kas papildina blīvu iekšējo paketi.
Foldinga ceļi un starpposmi
Proteīnu locīšanās parasti notiek caur vairākām ātrām un lēnām stadijām, bieži ar īslaicīgiem starpposmiem, piemēram, molten globule (daļēji salocīta, dinamiski nestabila struktūra). Mūsdienu skatījums izmanto enerģijas ainavas jeb "folding funnel" jēdzienu: no neorganizēta augsta enerģijas stāvokļa polipeptīds virzās uz zemu enerģijas, labi definētu dabisko stāvokli, taču ceļš var iet cauri daudziem lokāliem minimumiem.
Daži svarīgi aspekti:
- Ko-translacionāla locīšanās: daļa proteīnu sāk locīties jau pie ribosomas, kamēr tulkošana vēl notiek.
- Chaperonu loma: molekulārie palīgi (piem., Hsp70, Hsp90, Hsp60/GroEL) neizveido galīgo struktūru, bet palīdz novērst nepareizu saķeršanos un atvieglo pareizu locīšanos.
- Kofaktoru un ko-faktiļu nepieciešamība: daudzi proteīni prasa metālu jonus, kofaktorus vai disulfīdus, lai iegūtu stabilu formu.
- Multimerizācija: daudzu proteīnu funkcija prasa asociāciju vairākos ķēdēs — monomēri var būt nestabili līdz kompleksa izveidošanai.
- Intrinziķi nesaistītas zona (IDR): daļas proteīnos var apzināti palikt nesaistītas (intrinsically disordered regions) un būt funkcionālas, piemēram, signālu pārraidei vai regulācijai.
Nesalocīšanās, agregācija un slimību nozīme
Nepareiza locīšanās var novest pie daļiņu agregācijas vai stabilu beta-plakņu veidošanās, kas veido amiloīda fibrillas. Šādas izmaiņas saistītas ar vairākām slimībām:
- Neirodeģeneratīvas slimības: Alcheimera slimība (beta-amiloīds, tau), Parkinsona slimība (alfa-sinukleīns), Huntingtona slimība (mutants huntingtīns), ALS (SOD1, TDP-43) un citas — kur proteīnu agregāti bojā nervu šūnas.
- Prionu slimības: infekciozi misfolded prionu proteīni, kas spēj inducēt citu proteīnu konformācijas maiņu (piem., Creutzfeldt–Jakob slimība).
- Amiloidozes: sistēmiskas slimības, kur amiloīda nogulsnes bojā orgānus.
- Kmolekulāras slimības: piemēram, cistiskā fibroze lielākoties rodas no CFTR proteīna nepareizas locīšanās un degradācijas, kas samazina funkcionalitāti.
- Metaboliskas slimības: dažas endokrīnās problēmas (piem., II tipa cukura diabēts) asociētas ar amiloīdīgu peptīdu (IAPP) agregāciju aizkuņģa dziedzerī.
Agrākas kļūdas var izraisīt šūnu stresu, endoplazmatiskā retikuluma (ER) disfunkciju un aktivētu nepareizu proteīnu atbildes ceļus (Unfolded Protein Response — UPR). Ja kvalitātes kontrole neizdodas, proteīnu agregāti var kļūt toksiski, radot iekaisumu un šūnu nāvi.
Šūnas kvalitātes kontrole un proteīnu noārdīšana
Šūna izmanto vairākas sistēmas, lai uzraudzītu proteīnu kvalitāti:
- Molekulārie chaperoni (Hsp70, Hsp90, chaperonīni) — palīdz pareizai locīšanai un stabilizācijai.
- Proteasoma un ubiklīto-sistēma — degradē nepareizi salocītus vai nevajadzīgus proteīnus.
- Autofāgija — šūnas ceļš liela agregātu vai bojātu organellu likvidēšanai.
Kā pētām proteīnu locīšanos
Bieži izmantotās metodes un pieejas:
- Rentgenstruktūranalīze (X-ray), NMR un krio-elektronmikroskopija (cryo-EM) — trīsdimensiju struktūras noteikšanai.
- Cirkulārā dikroisma (CD) spektroskopija — sekundāro struktūru analīzei un termiskajai stabilitātei.
- Fluorescences metodes (t.sk. single-molecule FRET) — locīšanās kinētikas izsekošanai reālā laikā.
- MASU spektrometrija, bioķīmiski testu komplekti, fermenācijas un in vivo modeļi
- Bioinformātika un mašīnmācīšanās (piem., AlphaFold un citi modeļi) — strauji uzlabo secību-uz-struktūras prognozes.
Praktiska nozīme un terapijas iespējas
Izpratne par proteīnu locīšanos ir būtiska zāļu attīstībā, slimību diagnostikā un biotehnoloģijā. Terapijas pieejas ietver:
- Chaperonu modulētāji — palielināt šūnas spēju pareizi locīt vai noārdīt nepareizos proteīnus.
- Inhibitori, kas novērš agregāciju vai stabilizē nativu konformāciju.
- Imūnterapijas, kas mērķē uz agregātu komponentēm (piem., antivielas pret beta-amiloīdu).
- Genētiskas pieejas, lai izlabotu mutācijas, kas izraisa nepareizu locīšanos vai samazina proteīnu izteiksmi.
Noslēgums
Proteīnu locīšanās ir centrāls biologisks process, kas saista molekulāro struktūru ar funkciju. Lai gan daudzos gadījumos Anfinsena dogma ir pamatā (aminoskābju secība noteic strukturālo galīgo stāvokli), dzīvajās šūnās process bieži prasa kofaktorus, chaperonus un šūnas kvalitātes kontroli. Nepareiza locīšanās un agregācija ir saistīta ar plašu slimību spektru, tāpēc izpratne par šiem mehānismiem ir gan pamat-gan lietišķās biomedicīnas pētījumu uzmanības centrā.
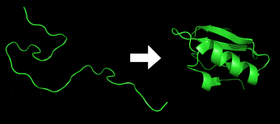
Proteīns pirms un pēc locīšanas
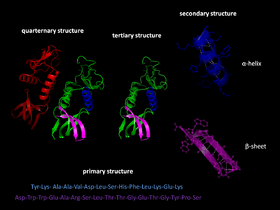
Olbaltumvielu locīšana ir trešais olbaltumvielu struktūras attīstības posms.
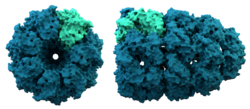
Šaperonīna struktūra. Šaperonīni palīdz dažu olbaltumvielu locīšanai.
Pavadoņi
Šaperonīni ir lieli proteīni, kas pēc sintēzes palīdz dažu proteīnu locīšanai. Šaperoni kopumā pirmo reizi tika atklāti, palīdzot histoniem un DNS savienoties, veidojot nukleosomas. Nukleosomas ir hromosomu pamatelementi. Tagad ir skaidrs, ka šādi tiek veidoti daudzi šūnu organoīdi.
Jautājumi un atbildes
J: Kas ir olbaltumvielu locīšana?
A: Olbaltumvielu locīšanās ir process, kurā polipeptīdu ķēde no nesalocītas lineāras aminoskābju ķēdes pārvēršas tai raksturīgajā trīsdimensiju formā.
J: Kas notur struktūru kopā?
A: Salocīta proteīna struktūru satur kopā ūdeņraža saites.
J: Kādi ir olbaltumvielu locīšanās posmi?
A: Olbaltumvielu locīšanas posmi ietver nesalocītu polipeptīdu vai nejaušu spirāli, kad tā tiek tulkota no mRNS līdz lineārai aminoskābju ķēdei un pēc tam mijiedarbojas savā starpā, lai izveidotu labi definētu trīsdimensiju struktūru, kas pazīstama kā dabiskais stāvoklis.
J: Kas notiek, ja olbaltumvielas nav pareizi salocītas?
A: Ja olbaltumvielas nesalokās savā dabiskajā formā, tās ir neaktīvas un parasti toksiskas. Tas var izraisīt vairākas slimības un alerģijas, ko izraisa nepareizi saliktas olbaltumvielas, kuras imūnsistēma neatpazīst.
J: Kas atrisināja olbaltumvielu locīšanas problēmu 2020. gadā?
A: 2020. gada 30. novembrī olbaltumvielu locīšanas problēmu atrisināja mākslīgā intelekta uzņēmums DeepMind.
J: Kas ir Anfinsena dogma? A: Anfinsena dogma nosaka, ka salocīta proteīna trīsdimensiju struktūru nosaka tā aminoskābju secība.
Meklēt