Sulfoksīds — definīcija, struktūra, īpašības un pielietojums (DMSO)
Sulfoksīds (DMSO) — definīcija, molekulas struktūra, ķīmiskās īpašības un pielietojums: sintēze, hiralitāte, ligandu uzvedība un praktiskie izmantojumi laboratorijā un rūpniecībā.
Sulfoksīds ir organiskā molekula, kurā sēra atoms ir saistīts ar diviem oglekļiem un vienu skābekļa atomu. To parasti iegūst, oksidējot tioēterus, neveicot turpmāko oksidāciju līdz sulfonam. Sulfoksīdiem ir raksturīga polāra S=O saite, un tie, tāpat kā daudzas citas sēru saturošas savienojumu grupas, var izdalīt raksturīgu sērainu vai ķiploku līdzīgu aromātu.
Sulfoksīdus parasti attēlo ar vispārējo formulu R-S(=O)-R'. Sulfuram ir formāla dubultā saite ar skābekli un vienkāršas saites ar oglekļiem; blakus S=O ir arī vientuļā pāra elektroni. Geometriski šis sēra atoms ir tuvu tetraedriskai koordinācijai, un, ja R un R' ir atšķirīgi, sērs var būt hirāls centrs — tas nozīmē, ka sulfoksīdus var sastapt kā enantiomērus un izmantot stereoselektīvā sintēzē vai kā kirālus palīglīdzekļus.
Sulfoksīdus bieži izmanto arī kā labus ligandus pārejas metāliem. Tie var koordinēties metalos gan caur skābekli (biežāk), gan retos gadījumos caur sēru, tādējādi ietekmējot metāla centra elektronisko vidi un reaktivitāti.
Dimetilsulfoksīds (DMSO) ir viens no svarīgākajiem un vispazīstamākajiem sulfoksīdiem — ķīmiski C2H6OS. DMSO plaši lieto kā polāru, aprotisku šķīdinātāju organiskajās reakcijās un bioķīmijā, jo tas šķīdina gan polāras, gan neitrālas vielas, ir miscible ar ūdeni un daudziem organiskajiem šķīdinātājiem. Praktiskas DMSO īpašības: liels viršanas punkts (~189 °C), kušanas punkts ap +18 °C, augsta dielektriskā konstante (aptuveni 47 pie 20 °C) un liela dipola momenta vērtība, kas padara to par labu mediējošu vidi polārajām reakcijām un jonizētiem reaģentiem.
Sulfoksīdiem ir plašs chemiķu lietojumu spektrs:
- Organiskajā sintēzē — sulfoksīdi tiek izmantoti kā šķīdinātāji (DMSO), reagenti (piem., Swern oksidācijas procesos DMSO piedalās alkoholu oksidācijās) un starpposma savienojumi.
- Kā funkcionālas grupas zāļu ķīmijā — daudzas farmaceitiskas vielas satur sulfoksīda grupu; piemēram, protonu sūkņu inhibitoru grupā pazīstami savienojumi (esomeprazols/omeprazols) satur sulfoksīda elementu, un sulfoksīdu chiralitāte var būt klīniski nozīmīga.
- Katalīzē un koordinācijas ķīmijā — sulfoksīdi darbojas kā ligandi pārejas metālu kompleksos, ietekmējot reakciju ceļus un selektivitāti.
- Biozinātnēs — DMSO lieto kā šūnu krioprotektantu (piem., 10% šķīdumi šūnu sasalšanai), kā arī kā šķīdinātāju bioloģiskajiem testiem un NMR spektroskopijā.
Reakcijas un pārveidojumi: sulfoksīdus iegūst, oksidējot tioēterus ar oksidētājiem, piemēram, m‑CPBA, H2O2 vai citiem peroksīdiem, bieži kontrolējot apstākļus, lai neoksidētu līdz sulfoniem. Sulfoksīdus var tālāk oksidēt līdz sulfoniem vai reducēt atpakaļ uz tioeteriem. Ir arī speciālas reakcijas, kurās sulfoksīdi piedalās, piemēram, Pummerer pāreja, kas ļauj veidot α‑substitūtas sulfīnu atvasinājumus.
Drošība un vides apsvērumi: daudzi sulfoksīdi, īpaši DMSO, ir relatīvi zema akūta toksicitāte, tomēr tiem ir specifiski riski. DMSO viegli iekļūst caur ādu un var transportēt šķīdinātājus vai zāļu atlikumus ādā, tāpēc laboratorijā jālieto aizsargcimdi un jāizvairās no tieša kontakta. Pēc ādas ekspozīcijas dažkārt cilvēkiem parādās ķiploku vai metāliska garša mutē un ādas kairinājums. Tāpat jāpievērš uzmanība pareizai DMSO atkritumu apsaimniekošanai un reaģentu tīrībai, jo tā šķīdinātspēja var padarīt citus ķīmiskos atliekus mobilus.
Kopsavilkumā, sulfoksīdi ir daudzpusīga un ķīmiski interesanta funkcionālā grupa ar nozīmīgu lomu organiskajā sintēzē, katalīzē, farmācijā un bioķīmijā. Dimetilsulfoksīds (DMSO) kalpo gan kā modelis šādas grupas īpašībām, gan kā praktiski nozīmīgs šķīdinātājs un reagents.
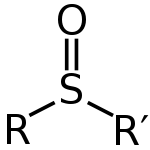
Sulfoksīda vispārējā struktūra
Jautājumi un atbildes
J: Kas ir sulfoxide?
A: Sulfoksīds ir molekula, kurā sēra atoms ir saistīts ar diviem oglekļiem un vienu skābekļa atomu.
J: No kurienes rodas sulfoksīds?
A: Sulfoksīds rodas, oksidējot tioēterus, neveicot visu ceļu līdz sulfonam.
J: Kāda ir sulfooksīdu vispārīgā formula?
A: Vispārējā sulfooksīdu formula ir R-S(=O)-R'.
J: Kāda ir atoma forma sulfoksīdos?
A: Atoma forma sulfooksīdos ir tetraedriska.
J: Vai sērs var būt hirāls centrs sulfoksīdos?
A: Jā, sērs sulfoksīdos var būt hirāls centrs.
J: Kas ir dimetilsulfoksīds un kāds ir tā pielietojums?
A: Dimetilsulfoksīds, pazīstams arī kā DMSO, ir svarīga sulfoksīda molekula, un to izmanto kā šķīdinātāju daudzās reakcijās, īpaši bioķīmijā.
J: Kāpēc sulfoksīdus izmanto kā labus ligandus pārejas metāliem?
A: Sulfoksīdus izmanto kā labus ligandus pārejas metāliem, jo tie spēj koordinēties ar metāla joniem, pateicoties elektronu pārim uz sēra atoma.
Meklēt