Pārejas stāvoklis ķīmijā — definīcija, aktivācijas enerģija un nozīme
Pārejas stāvoklis ķīmijā: definīcija, aktivācijas enerģija un nozīme — uzzini, kā tas ietekmē reakciju mehānismus un kinētiku.
Ķīmiskajā reakcijā pārejas stāvoklis ir punkts uz potenciālās enerģijas virsmas, kur reakcijas ceļā ir sasniegta maksimālā enerģija. To apzīmē ar divkāršu ‡ simbolu. Šo enerģijas slieksni sauc par aktivācijas enerģiju (Ea) — tieši šī enerģija nosaka, cik viegli reaģenti var pārvarēt barjeru un pārvērsties produktos. Ja divas vai vairākas molekulas saduras ar pietiekamu kinētisko enerģiju, lai sasniegtu pārejas stāvokli, sadursme var novest pie ķīmiskām pārmaiņām: veidojas jaunas saites, bet vecās tiek pārrautas.
No kā sastāv pārejas stāvoklis
- Pārejas stāvoklis nav izolējams, tas nav stabils savienojums — tāds stāvoklis pastāv ļoti īsu brīdi (bieži femtosekundes).
- Matemātiski tas ir sēdēšanas punkts (saddle point) uz potenciālās enerģijas virsmas, kur ir viens negatīvs (tā sauktais "imaginary") vibrācijasfrekvences modes virziens, kas atbilst reakcijas koordinātai.
- Grafikā pārejas stāvoklis atrodas starp reakcijas reaģentiem un produktiem, pie enerģijas maksimuma.
Atšķirība no starpstāvokļiem
Ir svarīgi nejaukt pārejas stāvokļus ar starpstāvokļiem. Starpstāvokļi (intermediāti) atbilst potenciālās enerģijas minimumiem un var būt relatīvi stabilāki — tos reizēm var izolēt vai vismaz novērot ilgākā laika skalā. Pārejas stāvoklis ir īslaicīgs un atrodas starp reaģentiem un starpproduktiem vai produktiem.
Reakcijas ātrums un teorijas
Pārejas stāvokļa enerģija tieši ietekmē reakcijas ātrumu. Šo sakarību apraksta:
- Arrhenius likums: k = A·exp(−Ea/RT), kur k — reakcijas konstante, A — frekvences faktors, R — universālā gāzu konstante, T — absolūtā temperatūra.
- Pārejas stāvokļa teorija (Transition State Theory, Eyring): k = (kBT/h)·exp(−ΔG‡/RT), kur ΔG‡ ir brīvais enerģijas barjeras pieaugums, kB — Bolcmaņa konstante, h — Planka konstante.
Kā pētīt pārejas stāvokļus
- Eksperimentāli: modernās femtosekunžu (femtochemistry) un pump–probe spektroskopijas metodes ļauj tiešā vai netiešā veidā sekot ļoti ātrām pārejas parādībām.
- Teorētiski/datorā: kvantuķīmijas metodes (piem., DFT, ab initio) ļauj atrast pārejas stāvokli uz potenciālās enerģijas virsmas, pārbaudot, ka tas ir pirmās kārtas sēdēšanas punkts (viena imaginarā frekvence) un izsekojot reakcijas ceļu ar IRC (Intrinsic Reaction Coordinate) aprēķiniem.
- Vibrāciju analīze: pārejas stāvoklim parasti ir tieksme pret vienu "reakcijas" modu, kas parādās kā imaginarā frekvence aprēķinātajā frekvenču spektrā.
Nozīme praksē
- Katalizatori darbojas, samazinot pārejas stāvokļa relatīvo enerģiju (jeb aktivācijas enerģiju) vai nodrošinot alternatīvu ceļu ar zemāku barjeru, tādējādi paātrinot reakciju.
- Izpratne par pārejas stāvokļiem ļauj ķīmiķiem plānot un optimizēt reakcijas: izvēlēties nosacījumus, reaģentus vai katalizatorus, kas samazina Ea vai stabilizē vēlamo pārejas stāvokli.
- Hammonda postulāts (Hammond postulate) sniedz praktisku vadlīniju: reakcijas pārejas stāvokļa struktūra vairāk līdzinās tam no posmiem (reaģentam vai produktam), kam ir tuvāka enerģija — tas palīdz paredzēt reakcijas alejkas raksturu un selektivitāti.
Praktiski piemēri un mērvienības
- Aktivācijas enerģija tiek izteikta kJ/mol vai eV. Neliels samazinājums Ea var izraisīt lielu reakcijas ātruma pieaugumu, īpaši pie pārtikas temperatūru svārstībām.
- Piemēri: SN2 reakcijās pārejas stāvoklis bieži vien ir vienlaicīgas saites veidošanās un laušanas stāvoklis; citu reakcionu — elektrofilās pievienošanās, redoks u. c. — pārejas stāvokļi var būt ļoti atšķirīgi pēc ģeometrijas un elektroniskā rakstura.
Kādi rīki ķīmiķiem noder
- Datorprogrammas molekulārām optimizācijām un frekvenču aprēķiniem (piem., Gaussian, ORCA, Q-Chem u. c.).
- Eksperimentālās metodes: ultrātrošā spektroskopija, masas spektrometrija ar ātru šķeirošanu, lāzertehnikas metodes.
- Ķīmiskās kinētikas pieeja: ķīmiskās kinētikas metodes apvienojumā ar teorētiskām prognozēm ļauj kvantitatīvi novērtēt pārejas stāvokļu ietekmi uz reakcijas ātrumu un mehānismu.
Pārejas stāvokļu izpēte ir būtiska, lai pilnībā izprastu reakciju mehānismus, dizainētu efektīvākus katalizatorus un paredzētu ķīmisko reakciju uzvedību. Gan eksperimentālā, gan teorētiskā pieeja ir nepieciešama, jo pārejas stāvokļi ir īslaicīgi un bieži sarežģīti.
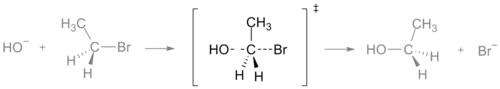
SN2 reakcijas pārejas stāvoklis
Jautājumi un atbildes
J: Kas ir ķīmiskās reakcijas pārejas stāvoklis?
A: Pārejas stāvoklis ir punkts, kurā ķīmiskajā reakcijā ir maksimālā enerģijas vērtība.
J: Kas ir aktivācijas enerģija ķīmiskajā reakcijā?
A: Enerģiju, kas nepieciešama, lai reakcija notiktu, sauc par aktivācijas enerģiju.
J: Kas notiek, ja ķīmiskajā reakcijā sajauc divas vai vairākas molekulas?
A: Ja divas vai vairākas molekulas sajaucas, tās saduras viena ar otru. Ja tās trāpās ar pietiekamu enerģiju, lai pārietu pārejas stāvoklī, tās reaģēs un veidos jaunas molekulas.
J: Ko ķīmiskās reakcijas grafikā vai zīmējumā apzīmē ar divkāršo dunci (‡)?
A: Divkāršais duncis (‡) tiek izmantots, lai ķīmiskās reakcijas grafikā vai zīmējumā atzīmētu pārejas stāvokli.
J: Kāpēc ir grūti izpētīt ķīmiskās reakcijas pārejas stāvokli?
A: Ķīmiskās reakcijas pārejas stāvokli ir ļoti grūti izpētīt, jo tā enerģija ir tik augsta, ka molekulas šajā stāvoklī atrodas ļoti īsu laiku, parasti femtosekundes.
J: Kas ir starpprodukts ķīmiskajā reakcijā?
A: Starpprodukts ir molekula, kas ķīmiskajā reakcijā atrodas minimālās enerģijas punktos un var dzīvot ļoti ilgi.
J: Kāpēc, lai izprastu reakciju mehānismus, ir svarīgi pētīt pārejas stāvokļus?
A: Pārejas stāvokļu izpēte ir svarīga, lai izprastu reakciju mehānismus, jo tā palīdz noteikt, kā reakcija notiek un kā to kontrolēt vai manipulēt.
Meklēt