Ķīmiskās reakcijas mehānisms — definīcija, posmi un piemēri
Ķīmiskās reakcijas mehānisms: skaidra definīcija, soli pa solim posmi un ilustrēti piemēri organiskajām un neorganiskajām reakcijām — saprotami, praktiski un piemēroti mācībām.
Reakcijas mehānisks ir soli pa solim aprakstīts, kā notiek ķīmiskā reakcija. Parasti reakcijā var redzēt tikai kopējās izmaiņas. Tas, kas notiek starp tām, reaģē pārāk ātri, lai to varētu pamanīt. Tos sauc par starpproduktiem, un, pārejot no viena starpprodukta uz otru, tiek šķērsots pārejas stāvoklis. Tomēr ir svarīgi saprast visus posmus, kas veido kopējo izmaiņu. Tas ir tāpēc, ka tad var izprast sarežģītākas reakcijas vai mēģināt panākt, lai reakcija noritētu noteiktā veidā.
Reakciju mehānismi ir dažādi. Organiskajā ķīmijā biežāk sastopamie ir nukleofīlā aizvietošana, eliminācija un pievienošana. Dažkārt cilvēki izmanto bultiņu stumšanu, lai attēlotu, kā reakcijas laikā pārvietojas elektroni. Tas ļauj viegli redzēt, kuras saites procesa laikā veidojas un kuras tiek pārrautas.
Galvenie jēdzieni un posmi
Elementārs solis — vienkāršs process, kurā mainās saites vai elektroniskā struktūra vienā notikumā; to parasti raksturo konkrēta molekulitātete (molekulāritāte). Starpprodukts — ķīmiski īslaicīga, bet relatīvi stabilāka suga starp elementārajiem soļiem. Pārejas stāvoklis — enerģijas maksimums elementārā soļa laikā; tas nav izdalāma suga, bet to attēlo reakcijas enerģijas profils.
Reakcijas mehānisma posmi bieži iedalās:
- Iniciācija: sākotnējs process, kas rada reaktīvas sugas (piem., radikāļus).
- Propagācija: virknes elementāru soļu, kuros starpprodukti veicina tālāku pārvēršanos.
- Terminācija: soļi, kuros reaktīvas sugas savienojas un reakcija apstājas vai maina gaitu.
Kā mehānismi tiek attēloti un noskaidroti
Mehānismus parasti attēlo ar bultām (elektronu pārvietošanās), ar enerģijas profila diagrammām un ar ķīmiskajām formulām. Lai pierādītu vai izslēgtu noteiktu mehānismu, ķīmiķi izmanto vairākas metodes:
- Kinetikas mērījumi: reakcijas ātruma atkarība no reaktantu koncentrācijām ļauj noteikt molekulāritāti un iespējamo ātrumu ierobežojošo (rate-determining) soli.
- Izotopu efekti: kinētiskie izotopu efekti (piem., D proti H) parāda, vai konkrēts H-atoms tiek pārnests elementārā solī.
- Stereohijeniskā analīze: produkta konfigurācija (inversija, saglabāšanās vai rašanās racēmiski) palīdz atšķirt starp koncertētu un posmveida mehānismu.
- Spektroskopija un ātras reakcijas tehnikas: NMR, IR, UV–Vis, masas spektrometrija, stop-flow mēra īslaicīgus starpproduktus.
- Trappingu eksperimenti: mēģinājumi sagūstīt starpproduktus ar ķīmiskām "ķērājiem" (trappers).
- Teorētiskā ķīmija: DFT un citi kvantu ķīmijas aprēķini, kas parāda pārejas stāvokļu un starpproduktu enerģijas.
Biežāk sastopamie mehānismi organiskajā ķīmijā
Nukleofīlā aizvietošana (SN1 un SN2)
- SN2 ir koncertēts vienpakāpju process: nukleofīls uzbrūk no aizmugures un izspiež atstājēju grupu vienlaikus; raksturīga inversija (Walden inversion) un reakcijas ātrums ir atkarīgs no abām reaktīvām sugām (binēra ātruma likme).
- SN1 ir divpakāpju: pirmajā solī veidojas karbokationa starpprodukts (ātrums ierobežojošais solis), pēc tam karbokationsu uzbrūk nukleofīls; tipisks terciārais alkilsāļi dod SN1 un bieži veidojas racēmiski maisījumi.
Eliminācija (E1 un E2)
- E2 — koncertēts deprotonācijas un atstājējgrupas aiziešanas solis; bieži prasa anti-periplanāru ģeometriju (protonu un atstājošo grupu jābūt pretēji vērstām molekulārajā telpā).
- E1 — divpakāpju ceļš ar karbokationa starpproduktu; biežāk novērojams, ja iespējama karbokationa stabilizācija.
Pievienošana pie dubultsaitēm
- Elektrofilā pievienošana alkēniem bieži norit ar starpproduktu — karbokationu vai halogenācijas gadījumā halonija jonu.
- Koncertētas reakcijas piemērs: hydroboration–oxidation pievieno B-H un H-OH sinhroni, dod syn-stereokemiju.
Radikālu ķēdes reakcijas — iniciācija ar radikāļu veidošanos (piem., klorinācija metānā ar gaismas iniciāciju), turpinājums ar atomu abraziju un produktu veidošanos, un terminācija, kur radikāļi savienojas.
Katalīze un mehānisma maiņa
Katalizatori maina reakcijas ceļu, bieži samazinot aktivācijas enerģiju vai radot alternatīvus starpproduktus. Heterogēnā katalīze (piem., metāla virsma) un homogenā ķīmija (piem., pārejas metālu katalītiskie cikli) demonstrē, kā katalizators var radīt vairākus elementārus soļus un cikļus — svarīgi saprast katra soļa mehānismu, lai optimizētu selektivitāti un ienesīgumu.
Praktiska nozīme
Saprotot reakcijas mehānismu, ķīmiķi var:
- paredzēt produktu sadalījumu un stereohijeniju,
- izvēlēties reakcijas nosacījumus (solvents, temperatūru, bāzes/nu kleofilus), lai veicinātu vēlamo ceļu,
- izstrādāt jaunus katalizatorus vai inhibtorus,
- izlabot drošību un izvairīties no nevēlamiem blakusproduktiem vai ķēdes reakcijām.
Konkretizēti piemēri
- SN2: metilhlorīda reakcija ar hidroksīdu: OH− uzbrūk pakaļpusē un izspiež Cl−; ātra, vienpakāpju, inversija.
- SN1: tert-butilhlorīda hidrolīze: Cl atstāj, veidojas tert-butilkarbokations, tad H2O uzbrūk, veidojot tert-butilspirtu.
- E2: 2-bromobutas reakcija ar spēcīgu bāzi: vienlaikus deprotonācija un Br aiziešana, veidojot butēnu; anti-periplanārais stāvoklis nosaka izomeru ratio.
- Radikāļu ķēde: metāna klorinācija: iniciācija (Cl2 → 2 Cl• ar hv), propagācija (Cl• + CH4 → HCl + CH3•; CH3• + Cl2 → CH3Cl + Cl•), terminācija ( CH3• + Cl• → CH3Cl utt.).
Izpratne par mehānismiem ir pamats ķīmijas sintēzēm, materiālu izstrādei un biokatalītiskām sistēmām. Ja vēlaties, varu pievienot reakciju enerģijas profilu attēlojuma aprakstu, redzamu piemēru ar bultām vai detalizētāku SN1/SN2 salīdzinājumu ar reakcijas ātruma likmēm.
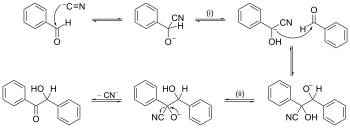
Reakcijas mehānisma piemērs ar bultas stumšanu
Jautājumi un atbildes
J: Kas ir reakcijas mehānisms?
A: Reakcijas mehānisms ir ķīmiskās reakcijas norises pakāpenisks skaidrojums.
J: Kāpēc ir svarīgi saprast visus reakcijas mehānisma posmus?
A: Ir svarīgi saprast visus reakcijas mehānisma soļus, lai izprastu sarežģītas reakcijas vai mēģinātu panākt, lai reakcija noritētu noteiktā veidā.
J: Kas ir starpprodukti ķīmiskajā reakcijā?
A: Starpprodukti ir vielas, kas rodas starp reakcijām, kuras reaģē pārāk ātri, lai tās varētu pamanīt ķīmiskajā reakcijā.
J: Kas ķīmiskajā reakcijā ir pārejas stāvoklis?
A: Pārejas stāvokli šķērso, ķīmiskās reakcijas laikā pārejot no viena starpprodukta uz citu.
J: Kādi ir biežāk sastopamie reakciju mehānismu veidi organiskajā ķīmijā?
A: Organiskajā ķīmijā biežāk sastopamie reakciju mehānismu veidi ir nukleofīlā aizvietošana, eliminācija un pievienošana.
J: Kas ķīmiskās reakcijas mehānismā ir bultas stumšana?
A: Dažkārt bultu virzienu izmanto, lai parādītu, kā reakcijas laikā pārvietojas elektroni. Tas ļauj viegli redzēt, kuras saites procesa laikā veidojas un kuras tiek pārrautas.
J: Kādu informāciju var iegūt, izprotot reakcijas mehānismu?
A: Izprotot reakcijas mehānismu, var iegūt informāciju par to, kā panākt, lai reakcija noritētu tā, kā vēlaties, vai izprast sarežģītākas reakcijas.
Meklēt