Eliminācijas reakcijas (E1, E2) organiskajā ķīmijā — definīcija un mehānisms
Uzzini eliminācijas reakciju definīciju un mehānismus (E1, E2) organiskajā ķīmijā — soli pa solim skaidrojums, piemēri un reakciju atšķirības.
Organiskajā ķīmijā eliminācijas reakcija ir reakcija, kad no lielākas molekulas tiek atdalīti daži atomi vai atomu grupa. Parasti šajā reakcijā rodas dubultā vai trīskāršā saite.
Ir divi galvenie veidi, kā veikt eliminācijas reakciju. Pirmo sauc par E1. Tā notiek divos posmos. Ja molekulā ir laba atstājgrupa, tā var izkļūt pati. Tad bāze vai cita viela var atdalīt otru grupu. Otrais veids ir E2. Tas notiek tikai vienā solī. Šajā gadījumā bāze atņem vienu grupu, vienlaikus atdalot atstāto grupu.
Bieži sastopama eliminācijas reakcija, kas notiek ar spirtiem. Ja tuvumā ir spēcīga skābe, var izdalīties ūdens molekula, veidojot dubultsaiti.
E1 — mehānisks apraksts un īpašības
E1 (eleminācija, unimolekulāra) notiek divos pakāpeniskos posmos:
- 1. solis: Atstājgrupa aiziet, veidojot karbokationu (pozitīvi lādētu oglekļa centru). Šis solis ir lēnākais un nosaka reakcijas ātrumu.
- 2. solis: Bāze atņem β-vodoru no kaimiņatomu, veidojot dubultu saiti.
Raksturojums:
- Kinetika: reakcijas ātrums ir atkarīgs tikai no substrāta koncentrācijas (1. kārtas reakcija).
- Primāri favorizēti ir terciārie un daļēji sekundārie substrāti, jo karbokationa stabilitāte (terciārais > sekundārais > primārais) veicina atstājgrupas iziešanu.
- Polāri protiskie šķīdinātāji (piem., alkoholi, ūdens) stabilizē jonus un bieži veicina E1 gaitu.
- Karbonēšanas un alkila pārvietojumu (hydride vai alkil shift) iespējamība: veidojoties karbokationam, bieži notiek pārejošas struktūras pārbīdes, kas var mainīt galaprodukta struktūru.
- Konkurence ar SN1: tā kā abas reakcijas iet caur to pašu karbokationu, bieži rodas gan substitūcija, gan eliminācija atkarībā no apstākļiem.
E2 — mehānisks apraksts un īpašības
E2 (eleminācija, bimolekulāra) ir koncertēta reakcija, kurā atstājgrupa un β-hidrogrupa tiek noņemtas vienlaikus vienā pārejas stāvoklī. Raksturojums:
- Kinetika: otrās kārtas reakcija — ātrums atkarīgs gan no substrāta, gan no bāzes koncentrācijas.
- Prasība pēc ģeometrijas: mērķis ir anti-periplanāra izvietojuma starp atstājošo grupu un β-hidrogēnu (tie atrodas vienā plaknē, 180°), kas nodrošina efektīvu σ→π pāreju. Šī prasība ietekmē stereokemiju galaproduktā.
- E2 parasti prasa spēcīgu bāzi (piem., NaOEt, KOtBu). Viegli aizvietojamas vai terotiski noslogotas bāzes var mainīt produkta izvēli (Hofmann vs Zaitsev).
- E2 nerada karbokacionus, tāpēc nav iespējas parasti veikt alkila pārvietošanos.
- Dos mēdz dominēt ar primāriem un sekundāriem substrātiem, īpaši, ja pieejama spēcīga, steriski vai ne-steriski neitrāla bāze.
Regio- un stereokīmija: Zaitseva un Hofmanna likumi
- Zaitseva likums: parasti dominē stabilākais (vairāk substitūtais) alkēns — jeb, ja iespējams, tiks izveidota vairāk substitūta dubultā saite (terciārais > sekundārais > primārais C atomu skaits pie dubultās saites).
- Hofmanna izņēmums: ja bāze ir liela un steriska (piem., t-BuO−), vai ja atstājgrupa ir īpaši apgrūtinoša, var tikt veidots mazāk substitūts (Hofmann) alkēns.
- Stereokīmija E2 gadījumā bieži vada anti-eliminācija, kas dod trans (E) alkēnus priekšrocībā pār cis (Z), ja tas ģeometriski iespējams.
Faktori, kas ietekmē E1 vs E2 (un konkurence ar SN1/SN2)
- Substrāta struktūra: terciārie C atbalsta E1; primārie vairāk virzās uz E2/SN2 atkarībā no bāzes/nukleofila.
- Bāzes stiprums: spēcīgas bāzes favorizē E2; vāji bāzes/nukleofili un stabilizēti karbokationi — E1.
- Atstājgrupa: labas atstājgrupas (I−, Br−, tosilāts u.c.) atvieglo gan E1, gan E2. Hidroksilgrupa tiek padarīta par labu atstājgrupu, protonējot to vai pārvēršot tosilātu/mesilātu.
- Šķīdinātājs: polāri protiskie šķīdinātāji stabilizē jonus (veicina E1/SN1). Polāri aprotiskie šķīdinātāji biežāk veicina E2/SN2, jo tie ne tik ļoti stabilizē anjonus un karbokationus.
- Temperatūra: augstāka temperatūra parasti veicina elimināciju salīdzinājumā ar substitūciju (entropijas ietekme).
- Cikliskas un ģeometriskas ierobežojumus: cikliski systemi var ierobežot iespēju izveidot nepieciešamo anti-periplanāro konfigurāciju, ietekmējot iznākumu.
Praktiski piemēri un reakciju nosacījumi
- Spirtu dehidrēšana (acid-catalyzed): piemēram, spirti protonējas ar skābi (piem., H2SO4), ūdens iziet kā laba atstājgrupa, veidojot karbokationu — process bieži norit pa E1 ceļu (īpaši terciāriem spirtu gadījumiem). Primārie spirtu gadījumi biežāk notiek ar E2 mehānismu vai ar speciāliem reagēntiem, lai novērstu pārbīdes.
- Izmantošana laboratorijā: ja vēlas izvairīties no pārvietojumiem, var izmantot nosacījumus, kas favorizē E2 (spēcīga bāze, zems polārs protisks šķīdinātājs) vai izmantot eliminēšanas reagētus — piemēram, POCl3/pyridine spirtu pārveidošanai bez rearrangementiem.
- Parasti lietoti reaktanti: spēcīgas bāzes: NaOEt, NaOMe, KOtBu; skābes dehidratācijai: H2SO4, H3PO4; atstājgrupu uzlabošanai: tosilāts (TsCl), mesilāts (MsCl).
Kopsavilkums
Eliminācijas reakcijas E1 un E2 ir pamatprocesi organiskajā sintēzē, kas ļauj pārveidot piesātinātas molekulas par alkēniem vai alkīniem. Izvēle starp E1 un E2 ir atkarīga no substrāta, bāzes/nukleofila stipruma, šķīdinātāja, temperatūras un atstājgrupas. E1 iet caur karbokationu un var izraisīt pārvietojumus; E2 ir koncertēta un bieži prasa anti-periplanāru ģeometriju un spēcīgu bāzi. Praktiskā sintēzē tiek izmantoti dažādi nosacījumi, lai kontrolētu reaktivitāti, regio- un stereokīmiju.
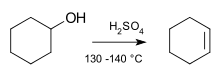
Eliminācijas reakcija cikloheksanola molekulā
Jautājumi un atbildes
J: Kas ir likvidācijas reakcija organiskajā ķīmijā?
A: Eliminācijas reakcija ir reakcija, kad no lielākas molekulas tiek atdalīti daži atomi vai atomu grupa, parasti veidojot dubultsaiti vai trīskāršu saiti.
J: Kādi ir divi galvenie veidi, kā veikt eliminācijas reakciju?
A: Eliminācijas reakciju var veikt šādi: E1 un E2.
J: Kāda ir atšķirība starp E1 un E2?
A: E1 notiek divos posmos, bet E2 - tikai vienā. E1 ietver atstāto grupu, kas iziet pati, un pēc tam bāze vai cita viela atņem otru grupu. E2 gadījumā bāze atņem vienu grupu, vienlaikus atdalot atstāto grupu.
J: Kad notiek parastā eliminācijas reakcija?
A: Bieži sastopama eliminācijas reakcija notiek ar spirtiem, kad blakus ir spēcīga skābe un var tikt atdalīta ūdens molekula, lai veidotu dubultsaiti.
J: Kas ir atdalītā grupa eliminācijas reakcijā?
A: Atdalītā grupa ir molekula vai atoms, kas var izkļūt pats no sevis eliminācijas reakcijā.
J: Kas ir bāze eliminācijas reakcijā?
A: Bāze ir viela, kas eliminācijas reakcijā var atdalīt grupu.
J: Vai eliminācijas reakcijas rezultātā var rasties trīskāršā saite?
A: Jā, eliminācijas reakcijas rezultātā var rasties trīskāršā saite.
Meklēt