Skābes — definīcija, pH, stiprās un vājās skābes (ķīmijas pamati)
Skābes — definīcija, pH, stiprās un vājās skābes: saprotami par disociāciju, pH vērtībām, to atšķirībām un ķīmijas pamatiem studentiem un interesentiem.
Raksts par noteiktām datu bāzu īpašībām ir atrodams vietnē ACID
Dažreiz skābe ir cits narkotikas LSD (lizergīnskābes dietilamīda) nosaukums.
Skābe ir viela, kas var ziedot ūdeņraža jonu (H+) (parasti tas ir protons) citai vielai. Skābju pH ir mazāks par 7,0 ūdens šķīdumos. Ķīmiskā viela var ziedot protonu, ja ūdeņraža atoms ir piesaistīts elektronegatīvam atomam, piemēram, skābeklim, slāpeklim vai hloram. Dažas skābes ir spēcīgas, bet citas vājas. Vājās skābes patur daļu savu protonu, bet stiprās skābes visus tos atdod. Visas skābes šķīdumos izdala ūdeņraža jonus. To, vai skābe ir vāja vai stipra, nosaka izdalīto jonu daudzums uz vienu molekulu. Vājas skābes ir skābes, kas daļēji atbrīvo pievienotos ūdeņraža atomus. Šīs skābes var pazemināt pH, disociējot ūdeņraža jonus, bet ne pilnībā. Vājajām skābēm parasti pH vērtība ir 4-6, bet stiprajām skābēm pH vērtība ir no 1 līdz 3.
Kāda ir skābe — definīcijas
Skābes skaidro vairākos veidos:
- Brønsted–Lowry skābe: viela, kas ziedo protonu (H+) citai vielai. Šī ir visizplatītākā skābes definīcija ūdens ķīmijā.
- Lewis skābe: elektronpareizu pieņēmējs — viela, kas pieņem brīvu elektronu pāri no citas vielas.
- Arrhenius skābe: viela, kas šķīstot ūdenī palielina H+ koncentrāciju (senāka definīcija, lietojama galvenokārt ūdens šķīdumos).
Skābju disociācija un stiprums
Monoprotiskas skābes disociācijas vienādojums parasti izskatās tā: HA ⇌ H+ + A−. Skābes stiprums tiek kvantitatīvi raksturots ar disociācijas konstanti Ka:
Ka = [H+][A−] / [HA]
Izplatītāka mērvienība ir pKa = −log10(Ka). Jo mazāks pKa, jo stiprāka skābe. Piemēri (aptuveni):
- HCl — ārkārtīgi spēcīga (pKa ļoti negatīvs), pilnībā disociē ūdenī pie parastām koncentrācijām.
- H2SO4 (pirmais protolīzes solis) — ļoti spēcīga.
- HNO3 — spēcīga skābe.
- Ķīmiskas vājās skābes: etiķskābe (CH3COOH, pKa ≈ 4.76), ogļskābe (H2CO3, pKa1 ≈ 6.35).
Jāuzsver: skābes "stiprums" nozīmē tendenci atdot protonu vienā molekulā — tas nav tas pats, kas šķīdības vai koncentrācijas nozīme. Stipra skābe var dot pH zem 0 pie augstas koncentrācijas; norādītās pH zonas (1–3 vai 4–6) ir tipiskas paraugkoncentrācijām.
Kā aprēķina pH vājam un stipram skābēm
- Stipra vienprotoniska skābe: [H+] ≈ C (kur C ir sākotnējā skābes koncentrācija), pH = −log10(C).
- Vāja vienprotoniska skābe (ja α ≪ 1): [H+] ≈ sqrt(Ka × C), un pH = −log10([H+]).
Ja nepieciešama lielāka precizitāte, jārisina stingrāks mass-action vienādojums, ņemot vērā disociācijas pakāpi un ūdens autoprotolīzi (H2O ⇌ H+ + OH−).
Konjugētā bāze, buferi un titrēšana
Katra skābe HA pēc protonu ziedošanas pārvēršas par konjugēto bāzi A−. Konjugēto pāru īpašības nosaka buferrisinājumu spēju stabilizēt pH. Buferi parasti satur vāju skābi un tās konjugēto bāzi (piem., CH3COOH / CH3COO−) un darbojas vislabāk ap skābes pKa vērtību ±1 pH vienību.
Titrēšanas laikā skābes reakcija ar bāzi ļauj noteikt skābes koncentrāciju pēc ekvivalences punkta; titrācijas kurve sniedz informāciju par skābes stiprumu un pKa.
Indikatori un pH mērīšana
pH var mērīt ar pH-metru vai krāsu indikatoriem (litmuss, fenolftaleīns u.c.). Indikatoru krāsu maiņa notiek pie konkrētām pH vērtībām, tāpēc to izvēle atkarīga no sagaidāmā pH diapazona.
Drošība un praktiski piemēri
- Daudzas skābes ir kodīgas — tās var kairināt ādu, radīt apdegumus un bojāt materiālus; strādājot, jālieto aizsardzības līdzekļi.
- Ikdienas piemēri: etiķis (vāja skābe — etiķskābe), citronu sula (citronskābe), akumulatoru šķidrums (sērskābe — spēcīga skābe), mājas tīrīšanas produkti ar skābēm.
Bāze ir skābes "ķīmiskais pretstats". Bāze ir viela, kas pieņem skābes ūdeņraža atomu. Bāzes ir molekulas, kas var sadalīties ūdenī un izdalīt hidroksīda jonus.
Papildus jēdzieni
- Amfotēras vielas: vielas, kas var uzvesties gan kā skābe, gan kā bāze (piemēram, ūdens).
- pKa un skābes izvēle: pKa ļauj salīdzināt dažādu skābju spēku neatkarīgi no koncentrācijas; maza pKa = spēcīga skābe.
- Neūdeņraža skābes: dažreiz par skābēm sauc arī vielas, kas pieņem protus vai elektronus citos vidēs (piem., Lewis skābes), tāpēc konteksts ir svarīgs.
Šis pārskats sniedz pamatzināšanas par skābēm, to īpašībām, stiprumu un praktisku izmantošanu. Lai iegūtu dziļāku saprašanu, ieteicams iepazīties ar skābju disociācijas vienādojumiem, Ka/pKa tabulām un titrēšanas eksperimentiem laboratorijā.

Sālsskābe (vārglāzē) reaģē ar amonjaka dūmiem, veidojot amonija hlorīdu (balti dūmi).
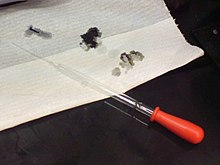
Skābes var būt bīstamas: Caurumi papīrā tika izveidoti ar 98% sērskābes šķīdumu.
Kā darbojas skābes
Skābes un bāzes parasti pastāv kopā līdzsvarā. Tas nozīmē, ka skābes paraugā dažas molekulas atdos savus protonus, bet citas tos pieņems. Pat ūdens ir skābā jona H3 O+ (ko sauc par hidronija jonu) un bāziskā jona OH- (ko sauc par hidroksīda jonu) maisījums. Hidronija jons atdos savu protonu hidroksīda jonam, veidojot divas H O molekulas2, kas ir neitrālas. Šī reakcija ūdens paraugā notiek nepārtraukti, bet kopumā paraugs ir neitrāls, jo hidronija un hidroksīda daudzums paraugā ir vienāds. Tomēr lielākajā daļā reakciju skābes un bāzes nav vienādā daudzumā, un šī nelīdzsvarotība ļauj notikt ķīmiskai reakcijai.
Katrai skābei ir konjugētā bāze, kas veidojas, atdalot skābes protonu. Piemēram, -. Skābes un tās konjugētās bāzes stiprums ir pretējs. Tā kā HCl ir spēcīga skābe, Cl-ir vāja bāze.
Īpašības
Skābēm var būt dažāda stipruma, dažas ir reaktīvākas par citām. Reaktīvākas skābes bieži ir bīstamākas.
Skābēm var būt ļoti dažādas īpašības atkarībā no to molekulārās struktūras. Lielākajai daļai skābju piemīt šādas īpašības:
- ēdot garšo skābi.
- var dzelt ādai, ja tiem pieskaras.
- var izraisīt metālu un ādas koroziju (vai bojājumus).
- elektrolīzes laikā var izmantot kā reaģentu kustīgo jonu klātbūtnes dēļ.
- pārvērš zilu lakmusa papīru sarkanā krāsā
- universālajā indikatorā ieslēgt sarkanu vai oranžu krāsu
- vadīt elektrību
Skābes var apdedzināt ādu, un apdeguma smagums ir atkarīgs no skābes veida un koncentrācijas. Šādiem ķīmiskiem apdegumiem nepieciešama tūlītēja medicīniskā palīdzība.
Tā kā skābes ziedo ūdeņraža jonus, visām skābēm jābūt ar ūdeņradi.

Brīdinājuma attēls, ko izmanto ar bīstamām skābēm un bīstamām bāzēm. Bāzes ir skābju pretstats.
Svarīgums
Skābes ir svarīgas. Nukleīnskābes, piemēram, DNS un RNS, satur ģenētisko kodu. Šīs molekulas nosaka daudzas organisma īpašības, tās tiek nodotas no vecākiem pēcnācējiem. DNS satur plānus, kā veidot olbaltumvielas, kas sastāv no aminoskābēm.
Taukskābes un taukskābju atvasinājumi ir vēl viena karbonskābju grupa, kam ir nozīmīga loma bioloģijā. Tās satur garas ogļūdeņražu ķēdes un karboksilskābes grupu vienā galā. Gandrīz visu organismu šūnu membrānu galvenokārt veido fosfolipīdu divslānis - hidrofobu taukskābju ķēžu micele ar polārām, hidrofilām fosfātu "galvas" grupām.
Cilvēkiem un daudziem citiem dzīvniekiem sālsskābe ir daļa no kuņģa skābes, kas izdalās kuņģī. Tā var palīdzēt hidrolizēt olbaltumvielas un polisaharīdus. Tā var arī pārvērst neaktīvo proenzīmu pepsinogēnu fermentā pepsīnā. Daži organismi ražo skābes aizsardzībai, piemēram, skudras ražo skudrskābi, bet astoņkāji - melno skābi, ko sauc par magnētu.
Lielākā daļa skābju ir sastopamas dabā. Dažas no tām ir šādas:
- Visticamāk, viens no pazīstamākajiem ir etiķis, kas satur etiķskābi, kas tam piešķir labi zināmo garšu.
- Slāpekļskābe, NHO,3 ir zināma aptuveni kopš 13. gadsimta.
- Citronskābes, C6 H8 O7, ir sastopamas daudzos augļos. Iespējams, ka tās 8. gadsimtā atklāja Gēbers.
- Pienskābi, C3 H6 O3, 1780. gadā atklāja Kārlis Vilhelms Šeile. To var atrast skābpiena produktos, piemēram, jogurtā.
- Sērskābi, H2 SO4, iespējams, atklāja Gēbers. Mūsdienās to var atrast baterijās.
Saistītās lapas
- Sārmu
- Folijskābe
Jautājumi un atbildes
Jautājums: Kas ir skābe?
A: ACID ir raksts par noteiktām datu bāzu īpašībām.
J: Kas vispār ir skābe?
A: Kopumā skābe ir viela, kas var ziedot ūdeņraža jonu (H+) citai vielai, un tās pH ir mazāks par 7,0.
J: Kādi ir nosacījumi, kādos ķīmiskā viela var ziedot protonu?
A: Ķīmiskā viela var ziedot protonu, ja ūdeņraža atoms ir piesaistīts elektronegatīvam atomam, piemēram, skābeklim, slāpeklim vai hloram.
K: Kāda ir atšķirība starp stiprajām skābēm un vājajām skābēm?
A: Stiprās skābes atdod visus savus protonus, bet vājās skābes dažus no tiem patur. To, vai skābe ir vāja vai stipra, nosaka atbrīvoto jonu daudzums vienā molekulā.
J: Kāds ir vājo skābju un stipro skābju pH diapazons?
A: Vājajām skābēm parasti pH vērtība ir no 4 līdz 6, bet stiprajām skābēm pH vērtība ir no 1 līdz 3.
J: Kas ir bāze?
A: Bāze ir skābes "ķīmiskais pretstats". Bāze ir viela, kas pieņem skābes ūdeņraža atomu. Bāzes ir molekulas, kas var sadalīties ūdenī un izdalīt hidroksīda jonus.
J: Kas ir LSD?
A: LSD (lizergskābes dietilamīds) ir narkotika, ko dažkārt dēvē par skābi, taču tā nav saistīta ar šajā rakstā minēto skābi.
Meklēt