Akumulators (baterija): definīcija, darbības princips un veidi
Akumulators (baterija): definīcija, darbības princips un veidi — uzzini, kā darbojas primārās un sekundārās baterijas, to priekšrocības, uzlāde un izvēle ikdienai.
Akumulatorā ķīmiskā enerģija tiek pārvērsta elektriskajā enerģijā ķīmiskas reakcijas rezultātā. Parasti ķīmiskās vielas atrodas akumulatora iekšpusē. To izmanto ķēdē, lai darbinātu citus komponentus. Akumulators ražo līdzstrāvas (DC) elektrību (elektrība, kas plūst vienā virzienā un nepārslēdzas uz priekšu un atpakaļ).
Elektrības izmantošana no ēkas kontaktligzdas ir lētāka un efektīvāka, taču akumulators var nodrošināt elektrību vietās, kur nav elektrības sadales. Tā ir noderīga arī lietām, kas pārvietojas, piemēram, elektriskajiem transportlīdzekļiem un mobilajiem tālruņiem.
Akumulatori var būt primārie vai sekundārie. Primārās baterijas tiek izmestas, kad tās vairs nespēj nodrošināt elektrību. Sekundāro var uzlādēt un izmantot atkārtoti.
Darbības princips
Akumulatora darbība balstās uz oksidēšanās-redukcijas (redoks) reakcijām. Tas satur divas elektrodas — anodu (negatīva) un katodu (pozitīva) — un elektrolītu, kas savieno abas puses jonu kustībai. Izlādējoties notiek šādas pamatfāzes:
- Elektroni plūst caur ārējo ķēdi no anodas uz katodu, radot elektrisko strāvu.
- Iekšpusē joni pārvietojas caur elektrolītu, lai saglabātu elektroneitrālumu.
- Ķīmiskās vielas mainās — piemēram, oksidējas vai reducējas — līdz ar enerģijas izsīkumu.
Uzlādes laikā šis process tiek apgriezts ar ārēja strāvas avota palīdzību: ķīmiskās vielas atgūst sākotnējo stāvokli un enerģija tiek uzkrāta.
Akumulatoru galvenās sastāvdaļas un parametri
- Šūnas spriegums: katras ķīmijas nominālais voltāžas līmenis (piem., li-ion ~3,6–3,7 V, NiMH/NiCd ~1,2 V, alkalīnskābes šūna ~1,5 V, svina‑skābes šūna ~2,0 V).
- Jauda (kapacitāte): mēra ampēr‑stundās (Ah) vai miliampēr‑stundās (mAh) — cik ilgi akumulators var darbināt ierīci pie noteikta strāvas patēriņa.
- Iekšējais pretestības līmenis: ietekmē, cik labi akumulators spēj dot lielu strāvu un cik daudz sprieguma pazudums notiek pie slodzes.
- Ciklu skaits un kalpošanas laiks: cik reizes akumulators var pilnībā uzlādēties un izlādēties, pirms kapacitāte būtiski samazinās.
- Dziļums (Depth of Discharge, DoD): cik liels procents no kopējās kapacitātes tiek iztukšots — dziļa izlāde parasti samazina ciklu skaitu.
Akumulatoru veidi un to īpatnības
Akumulatorus iedala pēc to izmantošanas iespējas (primārie vs sekundārie) un pēc ķīmiskā sastāva. Biežāk sastopamie veidi:
- Svina‑skābes (Lead‑acid): lēti, noturīgi pret skarbiem apstākļiem, piemēroti automašīnām, UPS un enerģijas uzkrāšanai. Parasti zema enerģijas blīvuma, bet augsta strāvas atdeve. Svina akumulatori bieži ir ļoti labi pārstrādājami.
- NiCd (nikle‑kadmijs): izturīgi pret augstām temperatūrām un lielām slodzēm, bet satur kaitīgu kadmiju un ir pakļauti "memories" efektam.
- NiMH (nikle‑metālu hidrīds): labāka kapacitāte nekā NiCd un mazāk "memory" efekta; izmanto kombinācijās ar portatīvajiem instrumentiem un baterijām (AA, AAA).
- Alkalīnskābes primārās baterijas: vienreizējās lietošanas baterijas (AA, AAA u.c.) ar nominālo spriegumu ~1,5 V. Lētas un plaši pieejamas.
- Litija jonu (Li‑ion) un litija polimēru (Li‑Po): augsta enerģijas blīvuma, salīdzinoši vieglas — plaši lieto mobilajās ierīcēs, datoros un elektrotransportā. Prasīgas uzlādes un drošības vadībā (risks termiskai runaway, jāievēro drošas lādēšanas spriegumi un temperatūras robežas).
Uzlāde un izlāde — praktiski
- Uzlādes režīmi: Li‑ion parasti uzlādē CC‑CV (konstanta strāva, pēc tam konstants spriegums). Svina‑skābes var uzlādēt ar konstantu spriegumu vai impulsu režīmiem.
- Izlādes strāva: daudzas ierīces prasa lielu īslaicīgu strāvu (piem., starterim automašīnā), citiem svarīga ir ilga, zema strāva (piem., saules enerģijas uzkrāšana).
- Pārlādēšana un pilnīga izlāde: pārlādēšana, īpaši bez pareizas vadības, var bojāt akumulatoru (vai izraisīt ugunsgrēku); daudzi sekundārie akumulatori cieš, ja tie tiek pilnībā izlādēti (atkarīgs no ķīmijas).
- Temperatūras ietekme: zemas temperatūras samazina efektīvo jaudu, augstas temperatūras paātrina nodilumu.
Drošība un pareiza lietošana
- Izmantojiet tikai ieteicamos lādētājus un ievērojiet ražotāja norādījumus.
- Nepakļaujiet akumulatorus pārmērīgai siltumam, liesmai vai mehāniskiem bojājumiem.
- Li‑ion baterijas var aizdegties pie bojājuma vai nepareizas uzlādes — izvairieties no bedrēm, īssavienojumiem un pārslodzes.
- Primārās baterijas nedrīkst mēģināt uzlādēt, ja tās nav paredzētas uzlādei.
Vides ilgtspēja un pārstrāde
Dažas bateriju ķīmijas satur smagus metālus (piem., svins, kadmijs) un baterijas jāvāc atsevišķi un jānodod pārstrādei. Svina‑skābes akumulatori parasti tiek ļoti efektīvi pārstrādāti, savukārt litija bateriju pārstrāde attīstās, bet prasības pieaug. Pareiza utilizācija samazina vides piesārņojumu un ļauj atgūt vērtīgas izejvielas.
Pielietojumi
- Mobilās ierīces: telefoni, planšetes, klēpjdatori (galvenokārt Li‑ion).
- Transportlīdzekļi: sākot no automašīnu starteriem (svina‑skābes) līdz pilnībā elektriskiem transportlīdzekļiem (Li‑ion baterijas enerģijas pārvaldībai).
- Energijas uzkrāšana: rezerves barošanas avoti (UPS), saules enerģijas sistēmas.
- Rīki, rotaļlietas un medicīniskās ierīces.
Kā izvēlēties akumulatoru
Izvēloties akumulatoru, ņemiet vērā:
- Enerģijas blīvumu: cik daudz enerģijas vienā svara vai tilpuma vienībā.
- Jaudas prasības: vai nepieciešama liela strāva īsu laiku vai ilga darbība pie mazāka patēriņa.
- Ciklu dzīve un uzticamība: cik ilgi akumulators kalpos konkrētā pielietojumā.
- Kostu un drošība: sākotnējās izmaksas pret ekspluatācijas un apkalpošanas izmaksām.
Kopsavilkums — praktiski padomi
- Izmantojiet ražotāja ieteiktos lādētājus un neļaujiet akumulatoriem pārsilt.
- Uzglabājiet sekundāros akumulatorus vēsā, sausā vietā ar daļēju uzlādi, ja tie netiks izmantoti ilgu laiku.
- Atdodiet izlietotās baterijas pārstrādei — tas ir drošāk un videi draudzīgāk.
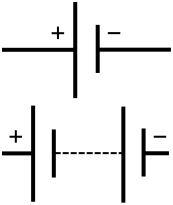
Akumulatora shematisks simbols

Ķīmiskais sastāvs akumulatora iekšpusē
Akumulatoram var būt viens vai vairāki elementi. Katram elementam ir anods, katods un elektrolīts. Elektrolīts ir galvenais akumulatora iekšējais materiāls. Tas bieži ir skābes paveids, un tam var būt bīstami pieskarties. Anods reaģē ar elektrolītu, lai iegūtu elektronus (tas ir negatīvais jeb - gals). Katods reaģē ar elektrolītu un uzņem elektronus (tas ir pozitīvais jeb + gals). Elektriskā strāva rodas, kad vads savieno anodu ar katodu, un elektroni pārvietojas no viena gala uz otru. (Taču akumulatoru var sabojāt tikai ar vadu, kas savieno abus galus, tāpēc starp abiem galiem ir nepieciešama arī slodze. Slodze ir kaut kas, kas palēnina elektronu kustību un parasti veic kādu lietderīgu darbību, piemēram, spuldzīte lukturī vai elektronika kalkulatorā).Elektrolīts var būt šķidrs vai ciets. Atkarībā no elektrolīta veida akumulatoru sauc par mitro vai sauso elementu akumulatoru.
Akumulatorā notiekošās ķīmiskās reakcijas ir eksotermiskas reakcijas. Šāda veida reakcijas rada siltumu. Piemēram, ja jūs atstājat klēpjdatoru ieslēgtu uz ilgu laiku un pēc tam pieskaraties akumulatoram, tas būs silts vai karsts.
Uzlādējams akumulators tiek uzlādēts, mainot akumulatorā notiekošās ķīmiskās reakcijas virzienu. Taču uzlādējamu akumulatoru var uzlādēt tikai noteiktu reižu skaitu (uzlādes laiks). Pat iebūvētās baterijas nevar uzlādēt mūžīgi. Turklāt katru reizi, kad akumulatoru uzlādē, tā spēja noturēt lādiņu nedaudz samazinās. Neuzlādējamas baterijas nedrīkst uzlādēt, jo no tām var noplūst dažādas kaitīgas vielas, piemēram, kālija hidroksīds.
Šūnas var savienot, lai izveidotu lielāku akumulatoru. Viena elementa pozitīvais savienojums ar nākamā elementa negatīvo tiek saukts par sērijveida savienošanu. Katras baterijas spriegums tiek saskaitīts kopā. Divas secīgi savienotas seš voltu baterijas veido 12 voltu spriegumu.
Vienas šūnas pozitīvo elementu savieno ar otras šūnas pozitīvo elementu, bet negatīvo - ar negatīvo, un to savieno paralēli. Spriegums paliek nemainīgs, bet strāva tiek saskaitīta kopā. Spriegums ir spiediens, kas spiež elektronus caur vadiem, un to mēra voltos. Strāva ir tas, cik daudz elektronu var iet vienlaicīgi, to mēra ampēros. Strāvas un sprieguma kombinācija ir akumulatora jauda (vati = volti x ampēri).
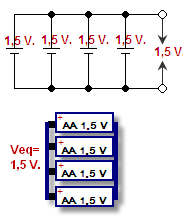
Paralēli savienoti akumulatori - attēlots shēmā un zīmējumā
Akumulatoru izmēri
Akumulatoriem ir dažādas formas, izmēri un spriegums.AA, AAA, C un D tipa baterijas, tostarp sārmu baterijas, ir standarta izmēru un formu, un to spriegums ir aptuveni 1,5 volti. Elementa spriegums ir atkarīgs no izmantotajām ķīmiskajām vielām. Elektriskais lādiņš, ko tas var nodrošināt, ir atkarīgs no tā, cik liels ir elements, kā arī no tā, kādas ķīmiskās vielas tas satur. Baterijas lādiņu parasti mēra ampērstundās. Tā kā spriegums paliek nemainīgs, lielāks lādiņš nozīmē, ka lielāks elements var nodrošināt vairāk ampēru vai darboties ilgāk.
Vēsture
Pirmais akumulators tika izgudrots 1800 Alessandro Volta. Mūsdienās viņa akumulatoru sauc par Voltaja bateriju.Mazās, modernās baterijās šķidrums ir imobilizēts sava veida pastas veidā, un viss ir ievietots hermētiskā apvalkā. Šī apvalka dēļ nekas nevar izplūst no akumulatora. Lielākos akumulatoros, piemēram, automašīnu akumulatoros, joprojām ir šķidrums, un tie nav hermētiski noslēgti. Otrā pasaules kara laikā tika izgudrots tāds akumulators, kurā kā elektrolītu izmanto izkausētus sāļus.
Akumulatoru veidi
- Sausie elementi, elementi, kuros kā elektrolīts nav šķidruma (vai ir imobilizēts šķidrums, piemēram, pasta vai gēls).
- Primārās šūnas, šūnas, kuras nevar atkārtoti uzlādēt.
- Sārma baterija, "sārmaina", nav uzlādējama
- Dzīvsudraba akumulators, nav uzlādējams
- Leclanche akumulators, "super heavy duty", nav uzlādējams
- Litija akumulators, nav uzlādējams, "monētas elements"
- Sudraba oksīda akumulators, nav uzlādējams, pulksteņa akumulators
- Voltaja kaudze, Allesandro Voltas pirmais akumulators
- Sekundārās šūnas, šūnas, kuras var uzlādēt.
- Hermētiski noslēgts svina skābes akumulators
- Litija jonu akumulators, uzlādējams, ko izmanto mobilajos telefonos un klēpjdatoros.
- Niķeļa kadmija akumulators, "NiCd", uzlādējams
- Niķeļa-metālhidrīda akumulators, "NiMH", uzlādējams
- Niķeļa-cinka akumulators
- mitrie elementi, elementi, kuros elektrolīts ir šķidrums.
- Svina skābes akumulators, uzlādējams, automašīnas akumulators
- Niķeļa-dzelzs akumulators, uzlādējams, Edisona akumulators
- Degvielas elements, ko uzlādē, pievienojot degvielu

Skats no augšas uz automašīnas akumulatoru
Alternatīvas baterijām
Kurināmā elementi un saules baterijas nav baterijas, jo tajās netiek uzglabāta enerģija.Kondensators nav akumulators, jo tas neuzkrāj enerģiju ķīmiskā reakcijā. Kondensatorā var uzglabāt elektroenerģiju un radīt elektroenerģiju daudz ātrāk nekā baterijā, taču parasti tas izmaksā pārāk dārgi, lai to izveidotu tik lielu kā bateriju. Zinātnieki un ķīmijas inženieri strādā, lai izveidotu labākus kondensatorus un baterijas elektriskajiem automobiļiem.
Nelieli elektroģeneratori, ko darbina ar rokām un kājām, var nodrošināt enerģijas padevi nelielās elektroierīcēs. Arī pulksteņa radioaparāti, pulksteņa lukturīši un līdzīgas ierīces ir aprīkotas ar uztinamo atsperi mehāniskās enerģijas uzkrāšanai.
Jautājumi un atbildes
J: Kas ir baterija?
A: Akumulators ir ierīce, kas ķīmiskā reakcijā ķīmisko enerģiju pārvērš elektriskā enerģijā.
J: Kā baterija ražo elektrību?
A: Akumulators ražo līdzstrāvas (DC) elektrību, kas plūst vienā virzienā un nepārslēdzas uz priekšu un atpakaļ.
J: Kur akumulatorā tiek glabātas ķīmiskās vielas?
A: Parasti ķīmiskās vielas parasti atrodas akumulatora iekšpusē.
J: Kāda ir atšķirība starp primāro un sekundāro akumulatoru?
A: Primāro bateriju izmet, kad tā vairs nespēj nodrošināt elektrību, bet sekundāro bateriju var uzlādēt un izmantot atkārtoti.
J: Kādēļ baterijas ir noderīgas?
A: Akumulatori ir noderīgi, lai nodrošinātu elektrību vietās, kur nav elektrības sadales, un lietām, kas pārvietojas, piemēram, elektriskajiem transportlīdzekļiem un mobilajiem tālruņiem.
J: Vai izmantot elektrību no kontaktligzdas ēkā ir lētāk un efektīvāk nekā izmantot akumulatoru?
A: Jā, izmantot elektrību no kontaktligzdas ēkā ir lētāk un efektīvāk nekā izmantot akumulatoru.
J: Kāda veida elektroenerģiju ražo baterija?
A: Akumulators ražo līdzstrāvas (DC) elektrību.
Meklēt