Pievienošanas reakcija: definīcija, mehānisms un piemēri organiskajā ķīmijā
Pievienošanas reakcija organiskajā ķīmijā: skaidra definīcija, soli pa solim mehānisms un ilustratīvi piemēri (hidratācija, nukleofīlais uzbrukums) — saprotami un precīzi.
Organiskajā ķīmijā pievienošanas reakcija notiek, kad divas molekulas savienojas, lai izveidotu lielāku molekulu. Šāda reakcija parasti var norisināties tikai tad, ja vienai no reagentiem ir dubultā vai trīskāršā saite — visbiežāk oglekļa-oglekļa dubults vai trīskāršs saišu centrs, bet pievienošanas reakcijas var attiekties arī uz citām saišu kombinācijām (piem., oglekļa–skābekļa u. c.). Vienu no abām reaģējošajām daļiņām parasti sauc par nukleofilu — tas ir reaktants, kas nodod vai dalās ar elektronu pāri, lai izveidotu jaunu ķīmisku saiti; otru sauc par elektrofilu, kas elektronus pieņem.
Pievienošanas reakcija ir pretēja eliminācijas reakcijai. Dažos gadījumos pievienošanās un eliminācija ir reversējas — reakcijas virzība atkarīga no termodinamikas un reakcijas apstākļiem (temperatūra, spiediens, katalizatori).
Galvenie pievienošanas mehānismi
- Elektrofilā pievienošanās: bieži sastopama alkenu un alkīnu reakcijās ar halogēniem, halogenūdeņražiem vai ar ūdeni (katalizētā hidratācija). Elektrofilais reaktants pirmo soli izmanto, lai veidotu starpposma kationu (piem., karbokationu), kuru pēc tam atbalsta nukleofils.
- Nukleofilā pievienošanās: raksturīga karbonilsavienojumiem (aldheīdi, ketoni). Nukleofils uzbrūk elektrofilajam oglekļa atomam karbonilā, veidojot tetraedrisku starpposmu. Šāda tipa reakcijas piemērs ir nukleofīlais uzbrukums karbonilam.
- Radikālā pievienošanās: notiek, ja reakciju iniciē brīvie radikāļi (piem., peroksīdu klātbūtnē). Raksturīga reakcijām ar halogenūdeņražiem, kur var rasties anti‑Markovnikova reģioselektivitāte.
- Koncertētas/cikloadīcijas: dažas pievienošanās notiek vienlaicīgi caur pāra elektronplūsmas maiņu (piem., Diels–Alder reakcija), kur nav starpposma karbokationa vai radikāļa.
Reģio‑ un stereoselektivitāte
Daudzas pievienošanas reakcijas ir selektīvas pēc vietas (reģioselektivitāte) un telpiskās uzbūves (stereoselektivitāte). Bieži minami principi:
- Markovņikova likums (elektrofilā pievienošanās alkeniem): H pievienojas pie oglekļa ar vairāk ūdeņražiem, bet elektrofilais fragments — pie tā, kas rada stabilāku karbokationu. Pretējs rezultāts (anti‑Markovnikov) var rasties radikālu mehānismā vai speciālu reaktantu klātbūtnē.
- Syn/anti stereokontrole: atkarīga no mehānisma — katalītiskā hidrogenēšana parasti dod syn-pievienošanos (vienā pusē), kamēr halogēnu pievienošana alkeniem bieži izriet anti-pievienošanos caur bridged halonium starpposmu.
Bieži piemēri un reaģenti
- Hidrogenēšana (H2/Pt, Pd, Ni) — reducē alkenus/alkīnus uz alkāniem; parasti syn‑pievienošana.
- Halogenēšana (Br2, Cl2) — pievieno halogēnus pie dubultajām saitēm; bieži anti‑stereokontrolēta.
- Hidrācijas reakcijas (piem., ūdens pievienošana dubultajai saitei, katalizēta ar dziļi skābi vai reģospecifiski ar citiem katalizatoriem) — veido spirtus; mehānisms var ietvert karbokationu vai elektrofilu intermediatūru.
- Hydroboration–oksidācija — pievieno BH3 sinhroni (syn), pēc oksidācijas dod spirtu ar anti‑Markovnikov reģioselektivitāti.
- Nukleofīlais pievienojums pie karboniliem — piemēram, organometāliskie reagenti (Grignard) pievienojas karbonilam, veidojot alkoholu pēc protonēšanas; šajā sadaļā ietilpst arī reduktīvas pievienošanas (NaBH4, LiAlH4).
Mehānisma faktori un praktiskie aspekti
Reakcijas gaita ir atkarīga no:
- substrāta stabilitātes (piem., karbokationu stabilitāte elektrofilās pievienošanās gadījumā),
- nukleofila vai elektrofilā spēka un koncentrācijas,
- reaksiijas vides (solvents, temperatūra),
- katalizatoriem (acīdi, bāzes, metālu katalizatori), kas var mainīt mehānismu un selektivitāti.
Kopsavilkums
Pievienošanas reakcijas ir centrālas organiskajā sintēzē: tās ļauj paaugstināt molekulu kompleksitāti, veidot jaunas saites un funkcionālas grupas. Atkarībā no mehānisma tās iedalās elektrofilajās, nukleofilajās, radikālajās un koncertētajās pievienošanās reakcijās. Praktiskā izvēle — reaktants, katalizators un apstākļi — nosaka reģio‑ un stereoselektivitāti, kā arī to, vai reakcija būs reversēta vai neatgriezeniska.
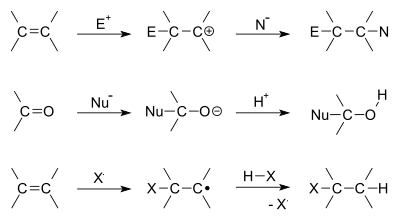
Daži pievienošanas reakciju piemēri
Jautājumi un atbildes
J: Kas ir pievienošanas reakcija organiskajā ķīmijā?
A: Aditīvā reakcija ir tad, kad divas molekulas apvienojas, lai izveidotu lielāku molekulu, un tā var notikt tikai tad, ja vienai no molekulām ir dubultā vai trīskāršā saite.
J: Kāda veida saitēm var būt pievienošanas reakcijas?
A: Oglekļa-oglekļa saites, oglekļa-skābekļa saites, oglekļa-askābes saites, oglekļa-askābes saites un citas saites var izraisīt pievienošanas reakcijas.
J: Kas ir nukleofils pievienošanas reakcijā?
A: Nukleofils ir molekula, kas ziedo elektronus citai molekulai, lai izveidotu jaunu saiti.
J: Kas ir elektrofils pievienošanas reakcijā?
A: Elektrofils ir molekula, kas pieņem elektronus, lai veidotu jaunu saiti.
J: Ar ko aditācijas reakcija atšķiras no eliminācijas reakcijas?
A: Aditācijas reakcijā divas molekulas savienojas, veidojot lielāku molekulu, bet eliminācijas reakcijā lielāka molekula sadalās divās mazākās molekulās.
J: Kāds ir pievienošanas reakcijas piemērs?
A: Ūdens pievienošana dubultajai saitei un nukleofīlais uzbrukums karbonilam ir izplatīti pievienošanas reakciju piemēri.
J: Vai aditīvās reakcijas var notikt bez dubultās vai trīskāršās saites?
A: Nē, aditīvajām reakcijām ir nepieciešamas dubultās vai trīskāršās saites vismaz vienā no iesaistītajām molekulām.
Meklēt