Akumulators (ķīmiskā šūna): definīcija, veidi un darbības princips
Uzzini, kas ir akumulators (ķīmiskā šūna): definīcija, uzlādējamo un neuzlādējamo veidi, darbības princips, izmēri un vēsture (Gastons Plāns, 1859).
Ķīmiskā šūna pārvērš ķīmisko enerģiju elektriskā enerģijā. Lielākā daļa bateriju ir tieši tādas ķīmiskās šūnas — tajās notiek ķīmiska reakcija, kas rada elektriskās strāvas plūsmu. Akumulators ir ierīce, kas satur vienu vai vairākas šādas šūnas un nodrošina elektrību dažādiem patērētājiem.
Komponentes un darbības princips
Katra akumulatora pamatā ir trīs galvenās sastāvdaļas: anods (negatīvais elektrods), katods (pozitīvais elektrods) un elektrolīts (viela, kas vada jonu plūsmu). Izlādes laikā notiek oksidēšanās pie anoda un reducēšanās pie katoda — šo ķīmisko pārmaiņu rezultātā elektroni plūst caur ārējo ķēdi no anoda uz katodu, radot elektrisko strāvu. Uzlādes laikā, ja tā ir iespējama, ārējā strāva spiež ķīmiskās reakcijas pretējā virzienā un atjauno sākotnējos materiālus.
Akumulatoru veidi
Vispārīgi akumulatorus iedala divās grupās:
- Neuzlādējami (primārie) — vienreizlietojami: nodrošina elektrību, līdz iekšējo ķīmisko vielu potenciāls ir izlietots, un pēc tam tos vairs nevar atjaunot. Tos bieži sauc par "izmanto un izmet". Piemēri: dažas litija primāršūnas un tradicionālās sārmu baterijas.
- Uzlādējami (sekundārie) — tos var uzlādēt, caur tiem caurlaižot elektrisko strāvu pretējā virzienā, tādējādi atjaunojot sākotnējo ķīmisko stāvokli. Tipiski piemēri: svina-skābes akumulatori (automašīnās), NiCd, NiMH un mūsdienu litija jonu (Li-ion) akumulatori. Uzlādējamās baterijas pirmo praktisko veidu 1859. gadā izgudroja franču inženieris Gaston Planté.
Biežāk izmantotās ķīmijas un to īpašības
- Svina-skābes (lead-acid) — lētas, spēj dot lielu sākotnējo strāvu (piem., auto startēšanai), bet smagas un ar ierobežotu ciklu skaitu.
- NiCd (nikls-kadmijs) — izturīgas pret lielām slodzēm un temperatūras svārstībām, bet satur toksisku kadmiju un ir pakļautas atmiņas efektam.
- NiMH (nikls-metālu hidrīds) — augstāka ietilpība nekā NiCd un mazāks videi kaitīgs efekts, bet joprojām ar salīdzinoši paaugstinātu pašizlādi.
- Li-ion (litija jonu) — augsta enerģijas blīvuma, zems svars, ilgs kalpošanas laiks un plašs pielietojums (telefoni, portatīvās ierīces, elektromobiļi). Nepieciešama aizsardzība pret pārlādēšanu un pārkaršanu.
- Alkaliskās (sārmu) — parasti neuzlādējamas (ir arī uzlādējamas versijas), piemērotas ikdienas ierīcēm: tālvadības pultis, pulksteņi u.c.
Galvenie parametri un ko tie nozīmē
- Spriegums (V) — atšķirīgām ķīmijām ir raksturīgs nominālais spriegums (piem., alkaliskajām šūnām ~1,5 V, NiMH/NiCd ~1,2 V, Li-ion ~3,6–3,7 V, svina-skābes ~2 V uz šūnu).
- Jauda / ietilpība (mAh vai Ah) — norāda, cik ilgi akumulators var piegādāt noteiktu strāvu; lielāka vērtība nozīmē ilgāku darbību vienā uzlādes/izlādes ciklā.
- Iekšējā pretestība — ietekmē sprieguma kritumu pie lielām slodzēm; zema iekšējā pretestība nozīmē labāku spēju piegādāt lielas strāvas.
- Pašizlāde — līmenis, cik ātri akumulators zaudē uzlādētību stāvoklī bez pieslēgtas slodzes.
- Ciklu skaits — cik reizes akumulators var tikt pilnībā uzlādēts un izlādēts, pirms tā ietilpība kļūst būtiski mazāka.
- Dziļā izlāde (DoD) — cik liela daļa enerģijas tiek izņemta no akumulatora; daudziem akumulatoriem bieža pilna izlāde samazina kalpošanas laiku.
Drošība un pareiza lietošana
Akumulatori var būt bīstami, ja netiek izmantoti pareizi. Daži pamatprincipi:
- Izmantojiet tikai atbilstošu lādētāju, kas paredzēts konkrētajai ķīmijai un baterijas tipam; pareizs uzlādes režīms pagarina kalpošanas laiku un novērš bojājumus.
- Nekad neīstenojiet īssavienojumu starp akumulatora spailēm — tas var izraisīt dzirksteles, siltumu un bojājumus.
- Neatstājiet litija jonu akumulatorus pārkarstam vai tiešā saulē; pārmērīga temperatūra var izraisīt termālu nestabilitāti (thermal runaway).
- Nepārdzīvojiet akumulatoru mehāniski — bojājumi var izraisīt noplūdes vai ugunsrisku.
Atkritumu apsaimniekošana un pārstrāde
Akumulatori satur materiālus, kas var būt videi kaitīgi (svins, kadmijs, liels litija daudzums u.c.). Tāpēc tos nedrīkst izmest sadzīves atkritumos. Nododiet izlietotās baterijas speciālās vākšanas vietās vai pārstrādes punktos. Pārstrāde ļauj iegūt vērtīgas izejvielas un samazina vides piesārņojumu.
Pielietojumi
Akumulatori tiek izmantoti ļoti plašā jomu spektrā: ikdienas sīkrīki (telefoni, portatīvie datori), rotaļlietas, fotoaparāti, viedierīces, automašīnas (startēšana, hibrīdiekārtas, elektromobiļi), rūpniecības enerģijas uzkrāšana un pat zemūdenēs un citos lielos transportlīdzekļos. Izvēle starp dažādām akumulatoru tehnoloģijām balstās uz vajadzīgo enerģijas blīvumu, izmaksām, drošību un ekspluatācijas prasībām.
Apkopojot: akumulators ir ķīmiskā šūna vai šūnu grupa, kas pārveido ķīmisko enerģiju elektrībā. Sapratne par to darbības principiem, ķīmijām, parametriem un drošības prasībām palīdz izvēlēties pareizo bateriju konkrētam pielietojumam un pareizi to lietot, uzturēt un utilizēt.
Ķīmisko elementu veidi
- Vienkārša šūna
- Sausais elements
- Mitrā kamera
- Degvielas elements
- Saules baterija
- Elektriskā šūna
Elektroķīmiskie elementi
Ļoti svarīga oksidēšanās un reducēšanās reakciju klase tiek izmantota, lai baterijās nodrošinātu noderīgu elektrisko enerģiju. Vienkāršu elektroķīmisko elementu var izgatavot no vara un cinka metāliem ar to sulfātu šķīdumiem. Reakcijas gaitā elektronus var pārnest no cinka uz varu pa elektrovadošo ceļu kā noderīgu elektrisko strāvu.
Elektroķīmisko šūnu var izveidot, ievietojot metāla elektrodus elektrolītā, kur ķīmiskā reakcija izmanto vai rada elektrisko strāvu. Elektroķīmiskos elementus, kas rada elektrisko strāvu, sauc par volta elementiem vai galvaniskajiem elementiem, un parastās baterijas sastāv no viena vai vairākiem šādiem elementiem. Citos elektroķīmiskajos elementos izmanto no ārpuses pievadītu elektrisko strāvu, lai izraisītu ķīmisku reakciju, kas nenotiktu spontāni. Šādus elementus sauc par elektrolītiskajiem elementiem.
Voltaja elementi
Elektroķīmisko šūnu, kas izraisa ārēju elektriskās strāvas plūsmu, var izveidot, izmantojot divus dažādus metālus, jo metāli atšķiras pēc to tendences zaudēt elektronus. Cinks vieglāk zaudē elektronus nekā varš, tāpēc, ievietojot cinka un vara metālu to sāļu šķīdumos, var izraisīt elektronu plūsmu caur ārējo vadu, kas ved no cinka uz varu. Tā kā cinka atoms nodrošina elektronus, tas kļūst par pozitīvu jonu un nonāk ūdens šķīdumā, samazinot cinka elektroda masu. Vara pusē divi saņemtie elektroni ļauj no šķīduma iegūto vara jonu pārvērst par nepiesātinātu vara atomu, kas nogulsnējas uz vara elektroda, palielinot tā masu. Abas reakcijas parasti raksta šādi
Zn(s) --> Zn2+(aq) + 2e
Cu2+(aq) + 2e ---> Cu(s)
Burti iekavās tikai atgādina, ka cinks no cietas vielas (s) pāriet ūdens šķīdumā (aq) un otrādi - varš. Elektroķīmijas valodā šos divus procesus, kas notiek pie abiem elektrodiem, parasti dēvē par "pusreakcijām".
| Zn(s) -> Zn2+(aq) + 2e |
|
| Cu2+(aq) + 2e- -> Cu(s) |
Lai voltaza elements turpinātu ražot ārējo elektrisko strāvu, šķīdumā esošajiem sulfāta joniem jāpārvietojas no labās puses uz kreiso, lai līdzsvarotu elektronu plūsmu ārējā ķēdē. Pašiem metāla joniem ir jānovērš kustība starp elektrodiem, tāpēc ar kādu porainu membrānu vai citu mehānismu ir jānodrošina negatīvo jonu selektīvā kustība elektrolītā no labās puses uz kreiso.
Lai piespiestu elektronus pārvietoties no cinka uz vara elektrodu, ir vajadzīga enerģija, un enerģijas daudzumu, kas voltāžā pieejams uz vienu lādiņa vienību, sauc par elementa elektromotora spēku (emf). Enerģiju uz lādiņa vienību izsaka voltos (1 volts = 1 džouls/kulons).
Skaidrs, ka, lai no šūnas iegūtu enerģiju, no cinka oksidācijas ir jāatdala vairāk enerģijas, nekā nepieciešams vara reducēšanai. Šāds elements šajā procesā var iegūt ierobežotu enerģijas daudzumu, jo procesu ierobežo pieejamā materiāla daudzums elektrolītā vai metāla elektrodos. Piemēram, ja vara pusē ir viens mols sulfāta jonu SO42-, tad process ir ierobežots līdz divu molu elektronu pārnesei caur ārējo ķēdi. Elektriskā lādiņa daudzumu, ko satur viens mols elektronu, sauc par Faradeja konstanti, un tas ir vienāds ar Avogadro skaitļa reizinājumu ar elektronu lādiņu:
Faradeja konstante = F = ANe = 6,022 x 1023 x 1,602 x 10-19 = 96,485 kulonu/mola
Voltaja elementa enerģijas iznākumu nosaka, reizinot elementa spriegumu ar pārnesto elektronu skaitu un Faradeja konstanti.
Elektroenerģijas izejas jauda = nFE
Elementa emf Ecell var paredzēt no abu metālu standarta elektrodu potenciāliem. Cinka/vara elementam standarta apstākļos aprēķinātais elementa potenciāls ir 1,1 volts.
Vienkāršā šūna
Vienkāršā šūnā parasti ir vara (Cu) un cinka (Zn) plāksnes atšķaidītā sērskābē. Cinks izšķīst, un uz vara plāksnes parādās ūdeņraža burbuļi. Šie ūdeņraža burbulīši traucē strāvas caurplūdi, tāpēc vienkāršo šūnu var izmantot tikai īsu laiku. Lai nodrošinātu vienmērīgu strāvu, nepieciešams depolarizators (oksidētājs), kas oksidē ūdeņradi. Daniela elementā depolarizators ir vara sulfāts, kas nomaina ūdeņradi pret varu. Leclanche baterijā depolarizators ir mangāna dioksīds, kas oksidē ūdeņradi līdz ūdenim.
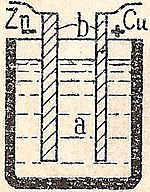
Vienkārša šūna
Daniela šūna
Angļu ķīmiķis Džons Frederiks Daniels 1836. gadā izstrādāja voltāza elementu, kurā izmantoja cinku un varu un to jonu šķīdumus.
Galvenais
- Cinka stienis = negatīvais termināls
- 2HSO4 = atšķaidīts sērskābes elektrolīts
- Porains katls atdala abus šķidrumus.
- CuSO4 = vara sulfāta depolarizators
- Vara pods = pozitīvais termināls
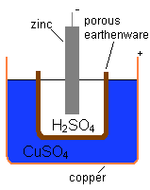
Daniela šūnas shēma
Jautājumi un atbildes
J: Kas ir ķīmiskā šūna un kāds ir tās uzdevums?
A: Ķīmiskais elements ir ierīce, kas ķīmisko enerģiju pārvērš elektriskā enerģijā. Tās mērķis ir ražot elektrisko strāvu, izmantojot ķīmisku reakciju.
Q: Kādas ir vairums bateriju?
A: Lielākā daļa bateriju ir ķīmiskie elementi.
J: Kas notiek baterijas iekšpusē, kas izraisa elektriskās strāvas plūsmu?
A: Akumulatora iekšpusē notiek ķīmiska reakcija, kas izraisa elektriskās strāvas plūsmu.
J: Cik ir bateriju veidu un kādi tie ir?
A: Ir divi galvenie bateriju veidi - uzlādējamas un neuzlādējamas baterijas.
J: Kas notiek, kad uzlādējama baterija ir izsmelta?
A: Neuzlādējama baterija nodrošina elektrību, līdz tajā esošās ķīmiskās vielas ir izsmeltas. Tad tā vairs nav derīga, un to var izmest.
J: Kas un kad izgudroja uzlādējamās baterijas?
A: Uzlādējamās baterijas izgudroja franču zinātnieks Gastons Plante 1859. gadā.
J: Vai baterijas var būt dažāda izmēra un kāds ir piemērs ierīcei, kurai nepieciešama liela baterija?
A: Jā, baterijas var būt dažādu formu un izmēru. Piemērs ierīcei, kurai nepieciešama liela baterija, ir zemūdene.
Meklēt