Virzītā evolūcija — definīcija, metodes un pielietojums biotehnoloģijā
Virzītā evolūcija: definīcija, metodes un pielietojums biotehnoloģijā — proteīnu inženierija, fermentu iegūšana, in vivo/in vitro stratēģijas un praktiski risinājumi.
Virzītā evolūcija (DE) ir eksperimentiāla metode, kuru izmanto, lai mērķtiecīgi uzlabotu fermentus, proteīnus vai RNS biotehnoloģiskām vai medicīniskām vajadzībām. Tā ir proteīnu inženierijas pieeja, kas imitē dabisko atlasi, taču notiek cilvēka izveidotā kontrolētā ciklā — mutācijas → variāciju bibliotēka → selekcija/skrīnings → atkārtota optimizācija.
Galvenā ideja un darba plūsma
Pamatideja ir pakļaut gēnu atkārtotām mutācijām, izveidojot lielu variantu bibliotēku, un pēc tam atlasīt tos variantus, kuriem piemīt vēlamās īpašības. Atlasītie gēni kalpo par paraugu nākamajai kārtai, līdz tiek sasniegts vajadzīgais raksturojums (piemēram, uzlabota aktivitāte, specifiskums vai stabilitāte).
Bibliotēku radīšana — mutāciju metodes
Variantu bibliotēku izveide var notikt dažādos veidos. Biežāk lietotās pieejas ir:
- Random mutagenesis (nejauša mutāciju ieviešana), piemēram, error-prone PCR, kur tiek palielināta DNS polimerāzes kļūdu frekvence.
- Saturation mutagenesis — konkrētas aminoskābes pozīcijas sistemātiska variēšana, lai pārbaudītu visas iespējamās izmaiņas.
- DNA shuffling (rekombinācija) — gēnu fragmentu sajaukšana un rekonstruēšana, lai radītu hibrīdus ar jauniem savienojumiem īpašībās.
- Site-directed mutagenesis — mērķtiecīgas izmaiņas zināmās vietās, balstoties uz struktūras vai funkcijas informāciju.
Selekcija pret skrīningu
Eksperimentos tiek lietotas divas galvenās pieejas, lai atrastu vēlamās variācijas:
- Selekcija — sistēma, kur tikai tie varianti, kas izpilda noteiktu funkciju, izdzīvo vai pavairojas. Selekcija ir ļoti efektīva, jo ļauj apstrādāt miljoniem kandidātu vienā reizē.
- Skrīnings — katrs variants tiek individuāli testēts attiecībā uz vēlamo īpašību (piem., aktivitātes mērījums). Tas prasa vairāk darba, bet ļauj kvantitatīvi novērtēt īpašības.
In vivo un in vitro pieejas
Virzītā evolūcija var tikt veikta in vivo (dzīvās šūnās) vai in vitro (šūnu ārpusē, brīvā šķīdumā vai mikrokapsulās):
- In vivo evolūcijas laikā katra šūna (bieži baktērijas vai raugs) tiek transformēta ar plazmīdu, kas satur vienu no daudziem bibliotēkas variantiem. Starp šūnām atšķiras tikai interesējošais gēns, bet pārējā genomiskā vide ir nemainīga. Šūnas ekspresē proteīnu citoplazmā vai uz virsmas, ļaujot pārbaudīt funkciju šūnu kontekstā. Tas ir īpaši noderīgi, ja attīstītais proteīns paredzēts lietošanai dzīvos organismos.
- In vitro evolūcijas gadījumā izmanto šūnu brīvu sistēmu, piemēram, in vitro transkripciju-translāciju, RNS vai proteīnu displeja sistēmas. Priekšrocības: var strādāt ar apstākļiem (temperatūra, šķīdinātāji), kas šūnām būtu nedraudzīgi; iespējams izteikt toksiskas olbaltumvielas; var izveidot ļoti lielas bibliotēkas — līdz pat 10^15 variantu, jo nav nepieciešams ievadīt DNS katrā šūnā.
Konkrētas metodes un platformas
Dažas pazīstamas un plaši izmantotas pieejas:
- Display metodes — phage display, ribosome display, mRNA display, kur proteīns vai peptīds tiek saistīts ar tās nosūtošo nukleīnskābi, ļaujot savienot fenotipu ar genotipu.
- Yeast/bacterial surface display — proteīna uzrādīšana uz šūnas virsmas, ko var analizēt, piemēram, ar FACS (šūnu šķirošanu pēc fluorescences).
- Kompartamentalizētas metodes — piemēram, compartmentalized self-replication (CSR) vai emulsion-bāzētas sistēmas, kur reakcijas notiek mikroskopiskās pūsliņās, ļaujot sasaistīt enzīma aktivitāti ar tās ģenētisko materiālu.
- Continuous evolution — nepārtrauktas evolūcijas platformas, kā phage-assisted continuous evolution (PACE), kur mutācijas un selekcija notiek pastāvīgi, samazinot manuālo darba ieguldījumu un paātrinot optimizāciju.
Pielietojums biotehnoloģijā
Virzītās evolūcijas rezultātā izstrādātie proteīni un RNS tiek plaši izmantoti:
- Industriālie fermenti ar uzlabotu thermostabilitāti, darbību ekstremālos pH vai jaunu substrātu specifiskumu (piemēram, pārtikas pārstrāde, tekstilrūpniecība, bioremediācija).
- Medicīnas lietojumi: terapeitiskās olbaltumvielas un monoklonālās antivielas ar uzlabotām saķeršanās īpašībām vai zemāku imunogenitāti.
- Enzīmi analītikā un diagnostikā, kas strādā ātrāk vai jutīgākās reakcijās.
- Metabolisma ceļu optimizācija mikroorganismos bioproduktu ražošanai (biofarmaceitikas, biokurināmie, specifiski savienojumi).
- Fundamentāla zinātne — izpratne par proteīnu struktūru–funkciju attiecībām un adaptācijas mehānismiem.
Ierobežojumi, drošība un ētika
Lai gan DE ir spēcīga, tai ir arī ierobežojumi un riski:
- Selekcijas sistēmas var izselektēt neparedzētus blakusefektus (piem., uzlabota aktivitāte pretgrupei, bet zemāka stabilitāte).
- Dažkārt ir tehniski grūti izveidot atbilstošu skrīninga vai selekcijas sistēmu jaunajam uzdevumam.
- Drošības aspekti — strādājot ar mutētiem gēniem un mikroorganismiem, jāievēro bioapdraudējumu kontroles un laboratorijas drošības protokoli. Būtiski izvērtēt un samazināt risku, ka jaunizveidotie varianti varētu negatīvi ietekmēt vidi vai cilvēkus.
- Ētiskas un regulatīvas normas var ierobežot noteiktu mērķu virzīto evolūciju, īpaši medicīnas un ģenētiski modificēto organismu jomā.
Nākotnes virzieni
Turpmākajos gados gaidāmi uzlabojumi augstas caurlaidspējas skrīningā, automatizācijā un mākslīgā intelekta integrācijā, kas ļaus ātrāk prognozēt noderīgas mutācijas un samazināt nepieciešamo eksperimentu skaitu. Arī nepārtrauktās evolūcijas platformas un hibrīdas in vivo/in vitro pieejas sola paātrināt jaunu biotehnoloģisku risinājumu attīstību.
Virzītā evolūcija ir elastīga rīkkopa: rūpīgi izstrādāta eksperimenta plānošana, atbilstoša mutāciju stratēģija un piemērota selekcijas/skrīninga metode nodrošina panākumus gan pamatazinātnē, gan komerciālās biotehnoloģiskās aplikācijās.
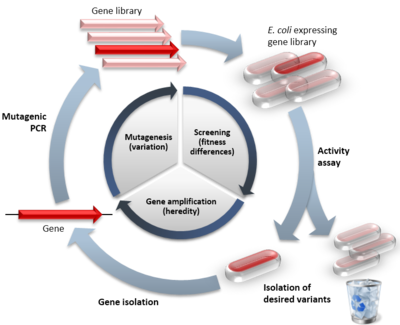
Virzītas evolūcijas piemērs salīdzinājumā ar dabisko evolūciju. Iekšējais cikls parāda trīs virzītās evolūcijas cikla posmus, iekavās norādot imitēto dabisko procesu. Ārējā aplī parādīti tipiska eksperimenta posmi. Sarkanie simboli norāda funkcionālos variantus, bālie simboli norāda variantus ar samazinātu funkciju.
Iedzimtības nodrošināšana
Kad ir izolēti funkcionāli proteīni, ir nepieciešams, lai arī to gēni būtu izolēti, tāpēc ir nepieciešama genotipa-fenotipa saikne.
Tas var būt kovalents, kad mRNS gēns ir saistīts ar proteīnu tulkošanas beigās ar puromicīnu.
Alternatīvi proteīnu un tā gēnu var glabāt kopā vai emulsijas pilienos. Izolētās gēnu sekvences pēc tam pavairo ar PCR vai ar transformētām saimnieka baktērijām. Kā veidni nākamajam mutagenēzes posmam var izmantot vai nu vienu labāko sekvenci, vai sekvenču kopumu. Atkārtoti diversifikācijas-selekcijas-amplifikācijas cikli rada fermentu variācijas, kas pielāgotas selekcijas procesam.

Izteikto olbaltumvielu var kovalentizēt ar tās gēnu (kā mRNS) (pa kreisi) vai ievietot vienā nodalījumā ar to (pa labi). Jebkurā gadījumā gēnu, kas kodē olbaltumvielu, izolē.
Piešķirtā balva
ASV inženieris Frānsiss Arnolds ir ieguvis Tūkstošgades tehnoloģiju balvu par novatorismu virzītas evolūcijas jomā.
Jautājumi un atbildes
J: Kas ir virzītā attīstība?
A: Virzītā evolūcija (DE) ir metode, ko izmanto, lai ražotu fermentus rūpnieciskiem vai medicīniskiem mērķiem. Tas ir proteīnu inženierijas veids, kas imitē dabisko atlasi.
J: Kā darbojas virzītā evolūcija?
A.: Virzītā evolūcija darbojas, gēnu pakļaujot atkārtotām mutāciju kārtām, radot variantu bibliotēku. Selekcija pēc tam izolē gēnus ar vēlamo funkciju, kurus izmanto kā veidnes nākamajā kārtā.
J: Kur var veikt virzītu evolūciju?
A: Virzītu evolūciju var veikt in vivo (dzīvās baktēriju vai rauga šūnās) vai in vitro (brīvi šķīdumā vai mikrodaļiņās).
J: Kādas ir priekšrocības, veicot virzītu evolūciju in vivo?
A. Virzītas evolūcijas in vivo priekšrocība ir tā, ka atlasa īpašības šūnu vidē, kas ir noderīgi, ja attīstīto proteīnu vai RNS paredzēts izmantot dzīvos organismos.
J: Kādas ir priekšrocības, veicot virzītu evolūciju in vitro?
A: Virzītas evolūcijas in vitro priekšrocība ir tā, ka ir iespējami dažādi apstākļi (piemēram, temperatūra, šķīdinātāji), un tā var izteikt olbaltumvielas, kas šūnām būtu toksiskas. Turklāt tā var izveidot daudz lielākas bibliotēkas, jo DNS nav jāievada šūnās.
J: Kas ierobežo to, ko var darīt in vitro eksperimenta laikā?
A: In vitro eksperimenta laikā veicamo darbību lieluma ierobežojumu bieži nosaka tas, cik daudz DNS ir jāievada šūnās.
Meklēt