Gēnu terapija — definīcija, ārstēšanas metodes un Glybera piemērs
Gēnu terapija: definīcija, ārstēšanas metodes un Glybera piemērs — kā vīrusu vektori ievada funkcionējošus gēnus, ārstējot lipāzes trūkumu un samazinot pankreatīta risku.
Gēnu terapija nozīmē, ka cilvēkam, kuram ir bojāts gēns, tiek ievadīts funkcionējošs gēns. Tā ir mērķēta medicīniska pieeja, kuras mērķis ir atjaunot vai kompensēt ģenētisku trūkumu šūnās, nevis tikai ārstēt simptomus. Eiropas Komisija ir apstiprinājusi šo metodi vienam konkrētam ārstēšanas veidam. Glybera produkta ārstēšanā izmanto vīrusu, lai inficētu muskuļu šūnas ar funkcionējošu gēna kopiju. Eiropas Komisija ir piešķīrusi Glybera tirdzniecības atļauju, kas nozīmē, ka to var pārdot visā ES. Glybera bija pirmais ģenētiskās terapijas produkts, kas saņēma ES apstiprinājumu, un tas izmantoja AAV (adenoasociēta vīrusa) vektoru, lai piegādātu mutēto lipāzes gēnu pacientiem ar ģimenisku lipoproteīnu lipāzes trūkumu (familiāla hlamikronēmijas sindroms). Lai gan tas tika apstiprināts, ražotājs vēlāk izņēma produktu no tirgus, galvenokārt komerciālu iemeslu un ļoti ierobežota pacientu skaita dēļ.
Kā darbojas gēnu terapija
Gēnu terapijas pamatideja ir piegādāt šūnām labu, funkcionējošu gēnu, kas spēj ražot nepieciešamo proteīnu vai korektīvi ietekmēt šūnas darbību. Pastāv divi pamatveidi, kā to panākt:
- In vivo — gēns tiek ievadīts tieši pacienta organismā (piemēram, ar injekciju muskuļos vai asinsvadā), un vektors piegādā gēnu mērķa šūnām.
- Ex vivo — pacienta šūnas tiek noņemtas no organisma, laboratorijā modificētas (gēns ievadīts šūnās) un tad atgrieztas atpakaļ pacientam.
Vektori — kā gēns nonāk šūnās
Visbiežāk lietotie piegādes līdzekļi ir vīrusi, jo tie dabiski iekļūst šūnās. Šādā veidā vīruss ir vektors. Tas nozīmē, ka tas ir nesējs; gēns ir ievietots vīrusa genomā, un vīruss to ievieto cilvēka šūnās. Vīrusi tiek modificēti tā, lai tie neražotu slimību, bet spētu nogādāt terapeitisko gēnu.
Parasti izmantotie vektori ir:
- Adenoasociētie vīrusi (AAV) — populāri to zemo imūnreaktivitātes un spēcīgās spējas inficēt dažādus audiem; tika izmantoti Glybera izstrādē.
- Retro- un lentivīrusi — spēj integrēt gēnu genomā, nodrošinot ilgstošu izteiksmi, lietojami galvenokārt ex vivo metodēs.
- Adēnovīrusi — efektīvi augstā izteiksmē, bet biežāk izraisa imūnreakciju.
Transfekcija un gēnu izslēgšana
Ļoti svarīgi atšķirt terminu “transfekcija” no citām gēnu manipulācijām. Transfekcija parasti nozīmē ģenētiskā materiāla ievadīšanu šūnās, bieži izmantojot vektoru (vīrusu vai nevīrusu metodes). Šī metode atšķiras no gēnu izslēgšanas metodes, kurā parasti netiek piegādāts jauns gēns, bet tiek slāpēta vai izslēgta noteikta gēna aktivitāte (piemēram, ar siRNA, antisense oligonukleotīdiem vai CRISPR/Cas sistēmu). Gēnu rediģēšana (CRISPR u. tml.) vēl vairāk paplašina iespējas — ne tikai piegādāt gēnu, bet arī tieši izlabot mutāciju keššūnu genomā.
Glybera — konkrērs piemērs
Vienam no miljona cilvēku ir bojātas lipāzes gēna kopijas, kas nepieciešamas tauku sadalīšanai. Tauku uzkrāšanās asinīs izraisa sāpes un aizkuņģa dziedzera iekaisumu (pankreatītu). Tas apdraud dzīvību. Līdz šim vienīgais veids, kā tikt galā ar šo slimību, ir diēta ar ļoti zemu tauku saturu.
Glybera bija terapija, kurā AAV vektors piegādāja modificētu lipoproteīnu lipāzes (LPL) gēna variantu (LPLS447X) tieši muskuļu šūnām, lai tās sāktu ražot funkcionālu lipāzi. Terapija tika ievadīta ar muskuļu injekcijām. Rezultātā daļai pacientu samazinājās pankreatīta epizožu biežums un uzlabojās tauku metabolisms. Tomēr efektivitāte un ilgtermiņa ieguvumi atšķīrās starp pacientiem. Pēc dažiem gadiem ražotājs izņēma Glybera no tirgus galvenokārt komerciju apsvērumu dēļ (ļoti reti saslimušo skaits un augstas izmaksas), tāpēc šobrīd tas nav plaši pieejams ārstēšanai.
Citas metodes un jaunākās pieejas
- Nevīrusu piegādes sistēmas — lipidu nanodaļiņas, elektroperforācija un cita ķīmiska pārnese; drošākas imūnreakcijas ziņā, bet nereti mazāk efektīvas.
- Gēnu rediģēšana (CRISPR/Cas) — potenciāls izlabot mutācijas tieši genomā; intensīvi attīstās, bet prasa rūpīgu drošības izvērtējumu.
- Imūnterapijas kombinācijas — gēnu terapija var kombinēties ar citām metodēm, piemēram, onkoloģijā, kur gēni tiek izmantoti, lai modificētu ierobežojošas imūnsistēmas šūnas.
Ieguvumi un riski
- Ieguvumi:
- Mērķēta ārstēšana, kas var novērst pamatcēloni, ne tikai simptomus.
- Dažos gadījumos — vienreizējas ārstēšanas efekts ar ilglaicīgu atlabšanu.
- Riski:
- Imūnreakcijas pret vektoru vai jauniegūto proteīnu, kas var samazināt efektivitāti vai radīt blakusparādības.
- Integrācijas risks (piem., ar retrovīrusiem) — pastāv retos gadījumos iespēja, ka gēna iekļaušanās genomā izraisīs onkogēnu aktivāciju.
- Limitēta ilgtermiņa datu pieejamība un augstas izmaksas ražošanai un ārstēšanai.
- Gēnu terapijas neatbilstība ģermlīnijas modifikācijai — medicīnā parasti tiek izmantotas tikai somatiskās (nevis pēcnācējus ietekmējošas) izmaiņas, jo ģermlīnijas modifikācijas rada būtiskas ētiskas un juridiskas problēmas.
Regulācija, drošība un pacientam svarīgā informācija
Gēnu terapija ārstēšanas uzsākšanai tiek stingri regulēta un prasa daudzpakāpju klīniskos pētījumus pirms apstiprināšanas. Pacientiem, kuri tiek uzskatīti par kandidātiem, nepieciešama rūpīga izvērtēšana, informēta piekrišana un ilgtermiņa uzraudzība pēc ārstēšanas, lai reģistrētu iespējamās blakusparādības un terapijas ilgtspēju.
Nākotnes perspektīvas
Gēnu terapija attīstās strauji: tiek uzlaboti vektori, piegādes metodes un gēnu rediģēšanas rīki, kas palielina drošumu un efektivitāti. Sagaidāms, ka tuvākajos gados redzēsim vairāk apstiprinātu terapiju retu ģenētisku slimību, dažādu asinsrades traucējumu un arī dažās onkoloģijas jomās. Tomēr piekļuves un izmaksu jautājumi joprojām būs nozīmīgi izaicinājumi.
Ja vēlaties padziļinātāku skaidrojumu par konkrētu metodi (piem., AAV vektori, CRISPR rediģēšana vai ex vivo pieejas) vai par Glybera klīniskajiem rezultātiem un tirgus izmaiņām, varu sagatavot papildus informāciju.
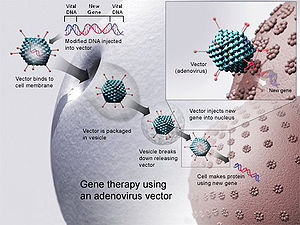
Gēnu terapija, izmantojot adenovīrusa vektoru. Jaunu gēnu ievieto vīrusā, ko pēc tam ievieto cilvēkā. Ja ārstēšana ir veiksmīga, jaunais gēns radīs funkcionējošu enzīmu, kas ārstēs slimību.
Ķīna
Ķīna bija pirmā valsts, kas 2003. gadā apstiprināja gēnu terapijas komerciālu ražošanu. Šī gēnu terapija ir paredzēta galvas un kakla plakanšūnu karcinomai (HNSCC) - vēzim, kas Ķīnā sastopams 10 % no visiem jauniem vēža gadījumiem. Ķīnā katru gadu ir 2,5 miljoni jaunu vēža pacientu.
Pasaulē pirmā komerciālā gēnu terapija, ko pārdod ar zīmolu Gendicine, arī izmanto vīrusu, lai ieviestu gēnu cilvēka genomā.
Pagātne
Par gēnu terapijas iespēju sāka runāt, tiklīdz tika apzināta DNS un RNS loma. Pirmā konkrētā publikācija tika publicēta 1972. gadā.
Nākotne
Vēl daudzi gēnu terapijas veidi ir izmēģinājumu stadijā. Ir skaidrs, ka notikumu cikls būs daļa no nākotnes klīniskās medicīnas: DNS sekvences analīze > identificēt bojātos gēnus > izlabot gēnus ar gēnu terapiju vai gēnu izslēgšanu. Dažreiz rodas problēmas ar blakusparādībām; tās var atklāt izmēģinājumu posmā. Pašlaik ir izveidota datubāze, kurā uzskaitīti visi zināmie klīniskie izmēģinājumi.
Jautājumi un atbildes
J: Kas ir gēnu terapija?
A: Gēnu terapija ir process, kurā pacientam ievada darbspējīgu gēnu, lai aizstātu bojāto gēnu.
J: Kādu produktu Eiropas Komisija ir apstiprinājusi gēnu terapijai?
A: Eiropas Komisija gēnu terapijai ir apstiprinājusi produktu Glybera.
J: Kā Glybera ārstē ģenētisku traucējumu?
A: Glybera izmanto vīrusu, lai inficētu muskuļu šūnas ar funkcionējošu gēna kopiju ģenētisko traucējumu ārstēšanai.
J: Kas ir lipāzes gēns un kāpēc tas ir svarīgs?
A: Lipāzes gēns ir gēns, kas nepieciešams tauku šķelšanai. Tas ir svarīgs, jo bojātas gēna kopijas var izraisīt tauku uzkrāšanos asinīs, izraisot pankreatītu, kas ir dzīvībai bīstams.
J: Kādu metodi Glybera izmanto gēnu terapijā?
A: Glybera izmanto transfekcijas metodi, kad vīrusa vektors ievada gēnu cilvēka šūnās.
J: Kas ir vīrusu vektors?
A: Vīrusu vektors ir nesējs, kas pārnēsā ģenētisko materiālu šūnās.
J: Ar ko transfekcijas metode atšķiras no gēnu izslēgšanas metodes?
A: Transfekcijas tehnika ietver vīrusu vektora izmantošanu, lai ieviestu gēna darba kopiju, savukārt gēnu izslēgšanas tehnikā neizmanto vīrusu vektoru. Gēnu izslēgšanas tehnikas mērķis ir noņemt vai izslēgt gēnu.
Meklēt