Atomu teorija: vēsture, uzbūve un pamatprincipi
Atomu teorija: uzzini atomu vēsturi, uzbūvi un pamatprincipus — no Demokrīta līdz kvarkiem. Saprotami skaidrojumi, attēli un piemēri ikvienam zinātkāram lasītājam.
Atomteorija ķīmijā un fizikā izskaidro, kā laika gaitā mainījusies mūsu izpratne par atomu. Kādreiz atomus uzskatīja par mazākajiem vielas gabaliņiem. Tomēr tagad ir zināms, ka atomi sastāv no protoniem, neitroniem un elektroniem. Šīs subatomārās daļiņas savukārt sastāv no kvarkiem un mijiedarbojas caur spēcīgajām un vājajām kodolspējām. Pirmo ideju par atomu radīja grieķu filozofs Demokrīts, bet daudzas mūsdienu teorijas pamatidejas formulēja britu ķīmiķis un fiziķis Džons Daltons.
Šī teorija attiecas uz cietām vielām, šķidrumiem un gāzēm, bet tā nav analoga plazmai vai neitronu zvaigznēm. Plazma ir jonizēta gāze, kur atomi ir sadalīti uz joniem un brīviem elektroniem, savukārt neitronu zvaigznes satur ārkārtīgi blīvu kodolmateriālu, kur parastā atoma struktūra vairs nepiemērojas.
Vēsturiskā attīstība
Atomteorijas attīstība iet cauri vairākiem svarīgiem posmiem:
- Antīkā doma: Demokrīta un citu domu skolas idejas par nedalāmu vielas daļu;
- Daltona modelis: ķīmiskie likumi un ideja par elementu atomiem ar noteiktu masu;
- J. J. Tomsona modelis: atklāja elektronu un ierosināja “raisītes” (plum pudding) modeli;
- Rutherforda izkliedes eksperiments: parādīja, ka atoma masa koncentrēta mazā, pozitīvā kodolā;
- Bora modelis: kvantizētas elektronu orbītas, kas izskaidroja spektrus;
- Kvantmehānika: Šrēdingera viļņu funkcija, Haizensberga nenoteiktības princips un mūsdienu orbitalu koncepcija.
Atoma uzbūve un galvenie jēdzieni
Atoma galvenie komponenti ir kodols un elektronmākonis. Kodolā atrodas protoni (pozitīvi lādēti) un neitroni (neitrāli). Elektroni (negatīvi lādēti) kustas ap kodolu, veidojot blīvu elektronu mākoni, kurā izpaužas varbūtības sadalījums par elektronu esamību konkrētā vietā. No svarīgākajiem jēdzieniem:
- Atoma numurs (Z): protonu skaits kodolā — nosaka elementa ķīmiskās īpašības;
- Masa skaitlis (A): protonu un neitronu kopskaits — nosaka izotopu masu;
- Orbitalas un enerģijas līmeņi: elektroni aizņem orbitālas ar noteiktām enerģijām, kas nosaka ķīmiskās saites;
- Pauli princips: katru kvantu stāvokli var aizņemt ne vairāk kā viens elektrons ar konkrētu spin vērtību.
Subatomārās daļiņas, kvarki un kodoldalības
Protoni un neitroni nav fundamentālas daļiņas — tie sastāv no kvarkiem, kurus savieno gluoni, kas pārraida spēcīgo mijiedarbību. Ir trīs “krāsas” kvarku mijiedarbībai un dažādi kvarku veidi (up, down, strange u.c.), kas skaidro hadronu īpašības. Kodolā darbojas arī vājā mijiedarbība (radojot radioaktīvos procesus) un elektromagnētiskā mijiedarbība starp lādiņiem.
Eksperimentālie pamati
Atomu un to komponentu eksperimentālais izpētes instruments ir plašs: no spektrālās analīzes, kas atklāja kvantizētus enerģijas līmeņus, līdz elektronu izkliedes eksperimentiem, rentgena kristalogrāfijai, elektronmikroskopijai un augsta enerģijas daļiņu paātrinātājiem, kas ļāva atklāt kvarkus un gluonus. Radioaktivitāte un kodolsintēze arī sniedz būtisku informāciju par kodola struktūru un spēkiem tajā.
Atomu loma ķīmijā un fizikā
Atomu īpašības un to savstarpējā mijiedarbība veido ķīmiskās saites un materiālu īpašības. Elektronu konfigurācija nosaka, kā atoms reaģēs, veidos saites un kuram vietā periodiskajā tabulā tas atrodas. Fizikā atomi ir svarīgi gan kvantu sistēmu izpētē, gan materiālu zinātnē, gan kodolfizikā un astrofizikā.
Limiti un speciālie stāvokļi
Lai gan atomu modelis skaidro lielu daļu par parastajiem materiāliem, pastāv situācijas, kur vienkāršs atoma attēlojums vairs neder: ļoti augstas temperatūras un plazmas stāvokļi, īpaši blīvas vielas (piemēram, neitronu zvaigznēs), un ļoti augstas enerģijas sadursmes, kurās rodas jaunas daļiņas. Šajās jomās nepieciešami īpaši modeļi un teorijas.
Kāpēc atomu teorija ir svarīga
Atomu teorija ir pamats, uz kura balstās ķīmija, materiālzinātne, daļiņu fizika un daudzi tehnoloģiskie risinājumi — no pusvadītājiem un medikamentiem līdz kodolenerģijai un medicīniskajai attēlveidošanai. Sapratne par atomu struktūru ļauj prognozēt un inženierēt materiālu īpašības un ķīmiskās reakcijas.
Kopsavilkumā: atomu teorija ir dinamisks jēdziens, kas savāc un izskaidro plašu datu loku — no antīkām domām līdz mūsdienu kvantu lauka teorijām. Tā palīdz izprast vielas uzbūvi un mijiedarbību gan ikdienišķos apstākļos (cietās vielas, šķidrumi, gāzes), gan ekstrēmos apstākļos, ja vien tiek pielietoti atbilstoši modeli un teorijas.

Demokrīts bija grieķu filozofs, 460. g. p.m.ē.

Roger Joseph Boscovich. Horvātu jezuīts, kurš izveidoja atoma teorijas prototipu.

Džons Daltons (1766-1844), angļu ķīmiķis un fiziķis
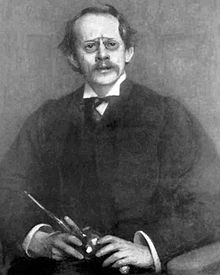
Sers Džozefs Džons Tomsons (1856-1940), angļu fiziķis, atklāj elektronu un tā negatīvo lādiņu. Viņš saņēma Nobela prēmiju fizikā.
Demokrita atomu teorija
Demokrits uzskatīja, ka, ja kaut ko atkal un atkal pārgriež uz pusēm, beidzot būs jāpārtrauc. Viņš teica, ka šo pēdējo vielas gabaliņu vairs nevar sagriezt mazāku. Šos mazos vielas gabaliņus Demokrits sauca par atomiem, kas nozīmē "nedalāms". Viņš uzskatīja, ka atomi pastāvēs mūžīgi, nekad nemainīsies un tos nevarēs iznīcināt. Demokrits uzskatīja, ka starp atomiem nav nekā un ka visu, kas mūs ieskauj, varētu izskaidrot, ja mēs saprastu, kā darbojas atomi.
Daži citi filozofi tam piekrita, bet citi tam nepiekrita. Viņiem nebija iespējas eksperimentāli pierādīt, vai viņa teorija ir patiesa vai nē.
Boskoviča atomu teorija
1758. gadā Rodžers Džozefs Boskovičs aprakstīja atomu teorijas priekšteci.
Daltona atomu teorija
1803. gadā angļu zinātnieks Džons Daltons, dzimis Kamberlendā, pārstrādāja Demokrita teoriju šādi:
- Visa matērija sastāv no atomiem.
- Atomi ir nedalāmas un neredzamas daļiņas.
- Viena un tā paša elementa atomi ir vienāda veida un masas.
- Ķīmiskos savienojumus veidojošie atomi ir noteiktās proporcijās.
- Ķīmiskās pārmaiņas atbilst ķīmiskajā reakcijā iesaistīto atomu reorganizācijai.
Daltons definēja atomu kā elementa pamatvienību, kas var piedalīties ķīmiskā savienojumā.
Thomsona atomu modelis
1850. gadā sers Viljams Krūkss (William Crookes) konstruēja "izlādes cauruli" - stikla cauruli, no kuras ir izņemts gaiss un kuras galos ir metāla elektrodi, kas savienoti ar augstsprieguma avotu. Izveidojot vakuumu caurulē, var novērot gaismas izlādi, kas iet no katoda (negatīvi lādēta elektroda) uz anodu (pozitīvi lādēts elektrods). Krukss šo izstarojumu nosauca par "katoda stariem".
Pēc katoda staru eksperimentiem sers Džozefs Džons Tomsons konstatēja, ka izstaroto staru veido negatīvi lādiņi, jo tos piesaista pozitīvais polis. Tomsons zināja, ka atomi ir elektriski neitrāli, bet viņš noteica, ka, lai tas notiktu, atomā jābūt vienādam negatīvo un pozitīvo lādiņu daudzumam. Negatīvos lādiņus nosauca par elektroniem (e-).
Pamatojoties uz pieņēmumiem par atomu neitrālo lādiņu, Tomsons ierosināja pirmo atoma modeli, kas tika aprakstīts kā pozitīvi lādēta sfēra, kurā bija iestrādāti elektroni (ar negatīvu lādiņu). Tas ir pazīstams kā plūmju pudiņa modelis.
1906. gadā Roberts Millikans noteica, ka elektroniem ir Kulona (C) lādiņš -1,6 * 10−19, kas ļāva aprēķināt to masu kā niecīgu - 9,109 * 10 −31kg.
Tajā pašā laikā 1886. gadā Eižens Goldšteins (Eugene Goldstein) ar katoda izlādes lampām veica eksperimentus, kas ļāva noteikt, ka pozitīvo lādiņu masa ir 1,6726 * 10 −27kg un elektriskais lādiņš +1,6 * 10 C−19. Lords Ernests Roterfords vēlāk nosauca šīs pozitīvi uzlādētās daļiņas par protoniem.

Tomsona modeļa shematisks attēlojums.
Roterforda atoma modelis
1910. gadā Jaunzēlandes fiziķis Ernests Roterfords izvirzīja ideju, ka atoma pozitīvie lādiņi galvenokārt atrodas atoma centrā, kodolā, un elektroni (e-) - ap to.
To pierādīja Roterfords, kad ar alfa starojuma avotu (no hēlija) trāpīja uz ļoti plānām zelta plāksnēm, ko ieskauj cinka sulfīda lampas abažūrs, kas, iedarbojoties alfa starojuma emisijai, radīja redzamu gaismu. Šo eksperimentu sauca par Geigera-Marsdena eksperimentu jeb Zelta folijas eksperimentu.
Šajā posmā jau bija zināmi galvenie atoma elementi, kā arī tika atklāts, ka elementa atomi var sastopami izotopos. Izotopi atšķiras pēc kodolā esošo neitronu skaita. Lai gan šis modelis bija labi saprotams, mūsdienu fizika ir attīstījusies tālāk, un mūsdienu idejas nav viegli saprotamas. Zināmu priekšstatu par mūsdienu atomu fiziku var gūt no zemāk tabulā redzamajām saitēm.
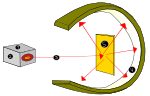
Lorda Ernesta Roterforda atomu eksperiments
Mūsdienu fizika
Atomi nav elementārdaļiņas, jo tos veido tādas subatomāras daļiņas kā protoni un neitroni. Protoni un neitroni arī nav elementārdaļiņas, jo tie sastāv no vēl mazākām daļiņām, ko sauc par kvarkiem, kurus kopā savieno citas daļiņas, ko sauc par glioniem (jo tie "salīmē" kvarkus atomos). Kvarki ir elementāras daļiņas, jo kvarki nav sadalāmi sīkāk.
Jautājumi un atbildes
J: Kas ir atoma teorija?
A: Atoma teorija izskaidro, kā laika gaitā mainījusies mūsu izpratne par atomu.
J: Par ko kādreiz uzskatīja atomu?
A: Kādreiz uzskatīja, ka atomi ir vismazākās vielas daļiņas.
J: No kā patiesībā sastāv atomi?
A: Atomi sastāv no protoniem, neitroniem un elektroniem.
J: No kā sastāv subatomārās daļiņas?
A: Subatomārās daļiņas sastāv no kvarkiem.
J: Kurš ir grieķu filozofs, kurš pirmais nāca klajā ar ideju par atomu?
A: Pirmo ideju par atomu radīja grieķu filozofs Demokrīts.
J: Kas ir britu ķīmiķis un fiziķis, kurš deva daudzas idejas mūsdienu teorijai?
A: Britu ķīmiķis un fiziķis Džons Daltons, kurš deva daudz ideju modernajai teorijai.
Vai atomu teorija attiecas uz plazmu vai neitronu zvaigznēm?
A.: Šī teorija attiecas uz cietām vielām, šķidrumiem un gāzēm, bet tā nav analoga plazmai vai neitronu zvaigznēm.
Meklēt