Karbēns — definīcija, īpašības, singleti, tripleti un reakcijas
Karbēns: definīcija, īpašības, singleti un tripleti, reakciju mehānismi. Uzzini par reaktivitāti, elektronkonfigurācijām, pievienošanas un heletropu reakcijām un Grubsa katalizatoru piemēru.
Karbēns ir oglekļa atoma fragments, kuram ir divas kovalentsaites uz apkārtējiem substituenti un divi papildu elektroni, kas neveido saites. Šos divus elektronus parasti attēlo kā divpunkti pie oglekļa centra (piem., R-(C:)-R' vai :C(R)2). Tā kā ap oglekli šādā konfigurācijā ir tikai seši valentielektroni, karbēni parasti ir relatīvi reaktīvi un īslaicīgi starpposmi ķīmiskajās reakcijās. (Sākotnējā tekstā lietotā saite uz “molekula ar” saglabāta: molekula ar un uz “oglekļa”: oglekļa.)
Elektroniskā struktūra: singlets un tripleti
Karbēni var pastāvēt divos galvenajos spinālos stāvokļos:
- Singlets — abiem neaizņemto elektronu pāri veido vientuļo pāri (bezsavaimes pāri) vienā orbitalē, tādējādi orbitālē ir pāris elektronu un cita orbitāle ir tukša. Singletkarbēni parasti ir elektrofīli un viegli pieņem elektronus no nucleofilām vielām. (Sākotnējā tekstā saglabāta saite uz “vientuļais pāris”: vientuļais pāris un uz “orbitālē”: orbitālē.)
- Tripleti — divi elektroni atrodas dažādās orbitalēs ar paralēliem spiniem (saskaņā ar Hundu likumu). Tripletkarbēni ir dirsradikali līdzīgi un biežāk veic reakcijas, kurās iesaistīta vienvirziena elektronpārs pārvietošanās, piemēram, H-atoma abstrakcija vai radikālas adīcijas.
Singlet–triplet enerģijas starpība (ΔES-T) ir atkarīga no substituentiem, hibridizācijas un elektroniskās stabilizācijas. Substituenti, kas stabilizē tukšo p-orbitāli (piem., ar rezonansi vai elektronu donori/akseptori), var mainīt preferenci uz singletu vai tripletu. Eksperimentāli tripletus bieži identificē ar elektronu spinrezonanses (ESR) metodēm.
Karbēnu īpašības un stabilitātes faktori
Lielākā daļa vienkāršo karbēnu ir ļoti reaktīvi un pastāv tikai īsu brīdi kā starpposmi. Tomēr ir vairākas stabilizācijas stratēģijas, kas ļauj iegūt ilgstošus vai pat izolējamus karbēnus:
- Elektroniska stabilizācija ar rezonanšu grupām vai heteroatomiem (piem., N, O) blakus karbēnam.
- Steriska aizsardzība ar lieliem substituentiem, kas novērš bimolekulāras savienošanās vai dimerizāciju.
- Specifiskas strukturālas klases, piemēram, nehlēmiski heterocikliskie karbēni (NHC), kas ir ļoti stabilas, izolējamas vielas ar plašu pielietojumu katalīzē.
Karbēnu klasifikācija (īsi)
- Fischer karbēni — parasti saistīti ar vēlajiem pārejas metāliem, substituenti, kas piešķir karbēnam elektrofīlas īpašības; bieži stabilizēti ar elektronatvilcīgām grupām.
- Schrock karbēni — saistīti ar agrākiem pārejas metāliem, karbēna C atoms parasti ir nukleofīls.
- Neatkarīgie (orgāniski) karbēni — piemēram, NHC, kuri var būt stabilizēti tā, ka tos var izolēt un lietot kā ligandus vai katalizatorus.
Karbēnu rašanās veidi
Biežākās karbēnu ģenerēšanas metodes laboratorijā:
- Termiska vai fotokinētiska diazo savienojumu dekompozīcija (piem., R2C=N2 → R2C: + N2). Diazo savienojumi ir plaši izmantots karbēnu avots.
- Alpha-eliminācija vai dehidrīdogēnošanās no halogēnsastopiem prekursoriem (piem., dehalogenācija ar bāzi).
- Fotolīze vai termiskais sadalījums diazirīnu savienojumos.
- Metālkatalizēta karbēna pārvade no diazo savienojumiem uz organisko substrātu (plaši izmantota karbēna pārvades ķīmija).
Raksturīgās reakcijas
Karbēni piedalās daudzveidīgās reakcijās atkarībā no to spināla stāvokļa un elektroniskajām īpašībām. Biežākie reakciju tipi:
- Adīcijas uz dubultsaitēm — karbēni var pievienoties pie alkeniem, veidojot ciklopropāna atvasinājumus (piem., ciklopropanācijas reakcijas). (Sākotnējā tekstā saglabāta saite uz “pievienošanas reakcijas”: pievienošanas reakcijas un uz “dubultsaitēm”: dubultsaitēm.)
- H-atoma abstrakcija un radikālas reakcijas — īpaši tripletkarbēni, kas darbojas kā radikālas sugas.
- Insercijas — karbēni var ielēkt C–H vai heteroatomu-saites vietā, radot jaunas saites.
- Reakcijas ar nukleofiliem vai elektrofiliem — atkarībā no karbēna dabas tas var rīkoties gan kā nukleofils, gan kā elektrofils. (Sākotnējā tekstā saglabātas saites uz “elektrofili”: elektrofili un “nukleofili”: nukleofili.)
- Reorganizācijas un dimerizācijas — ļoti reaktīvi karbēni var dimerizēties vai piedalīties pārbūvēs, kas rada dažādus sarežģītus produktus.
Praktiskie pielietojumi un piemēri
Karbēnu ķīmija ir svarīga organiskajā sintēzē un katalīzē. Piemēri un nozīmīgi sasniegumi:
- Grubsa katalizators — plaši lietots olefīnu metatēzes katalizators; tādās reakcijās tiek iesaistīti metāls-karbēnu starpposmi. Slavens piemērs ir Roberts Grubbss (Robert Grubbs) izstrādātais Grubsa katalizators.
- Nehlēmiski heterocikliskie karbēni (NHC) — izmantoti kā stabilizēti ligandi pārejas metālu katalizētos procesos un kā organokatalizatori, pateicoties to spējai dot elektronus un stabilizēt metālu centru.
- Karbēnu pārvades no diazo savienojumiem ir būtiska metode ciklopropanāciju, C–H aktivācijas un selektīvu funkcionalizāciju iegūšanai.
Analītiskās metodes un novērošana
Karbēnus bieži identificē un pētī ar šādām metodēm:
- Elektronu spinrezonanse (ESR) — īpaši noderīga tripletu detektēšanai.
- UV/Vis un fotofizikālie mērījumi — karbēnu ģenerācijas un reaģēšanas laika analīze.
- Ķīmiskas fiksācijas (trapping) — karbēnu ķīmisko reakciju produktu analīze, lai secinātu par sākotnējo starpposmu.
Kopsavilkumā, karbēni ir svarīgi, daudzveidīgi un interesanti starpposmi organiskajā un organometāliskajā ķīmijā. To īpašības (singlet/triplet, elektrofīlums/nukleofīlums, stabilitāte) lielā mērā nosaka reakciju laukumu un praktiskos pielietojumus.
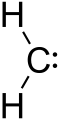
Karbēns
Jautājumi un atbildes
J: Kas ir karbēns?
A: Karbēns ir molekula ar oglekļa atomu, kuram ir divas saites un divi citi elektroni, kas neveido nekādas saites.
J: Kāpēc karbēns ir reaktīvs?
A: Ogleklim karbēnā ir tikai 6 elektroni, tāpēc tas ir diezgan reaktīvs.
J: Kāda ir karbēna vispārīgā formula?
A: Karbēna vispārējo formulu var rakstīt kā R-(C:)-R'.
J: Kādi ir divi karbēnu veidi?
A: Divi karbēnu veidi ir singlets un triplet.
J: Kāda ir atšķirība starp singletu un tripletu karbēnu?
A: Singletkarbenā divi elektroni, kas neveido saites, ir kā vientuļais pāris un atrodas vienā orbitālē. Tripleta karbēnā abi elektroni atrodas dažādās orbitālēs un tiem ir vienāds spins.
Kādas reakcijas var veikt karbēni?
A: Karbēni var veikt daudzas reakcijas. Tie var būt gan elektrofili, gan nukleofili, un tiem patīk veikt adīcijas reakcijas ar dubultsaitēm. Tie ir sastopami arī heletropu reakcijās.
J: Vai karbēni ir stabili?
A: Lielākā daļa karbēnu ir ļoti nestabili, bet daži var pastāvēt ilgu laiku. Piemērs ir Grubsa katalizators, ko izstrādāja Roberts Grubss.
Meklēt