Atoma orbitāles — definīcija, tipi un nozīme kvantu mehānikā
Uzzini atoma orbitāļu definīciju, tipus (s, p, d, f), nozīmi kvantu mehānikā un elektronu konfigurācijas skaidrojumu saprotamā, vizuāli bagātinātā formā.
Atoma orbitāles ir vietas ap atoma kodolu, kur jebkurā brīdī visdrīzāk atrodas elektroni. Tā ir matemātiska funkcija, kas apraksta viena elektrona vai elektronu pāra viļņveida uzvedību atomā. Precīzāk — orbitāle ir viļņu funkcija (mākslīgā valodā: viļņa amplitūda), kuras kvadrāts sniedz varbūtības blīvumu, cik liela iespējamība, ka elektrons atradīsies konkrētā telpas punktā.
Vārds "orbitālais" ir lietots tāpēc, ka tika uzskatīts, ka elektronu uzvedība ir līdzīga Saules sistēmas uzvedībai, kur kodols ir kā saule, bet elektroni riņķo kā planētas. Mūsdienu kvantu mehānika gan rāda, ka elektronu kustība nav klasiska "riņķošana" — tas ir viļņveida un varbūtību aprakstošs process.
Atomu orbitāļu skaitu elementā nosaka periods, kurā atrodas elements. Elektroni pārvietojas starp orbitālēm atkarībā no tā, cik ātri tie pārvietojas un cik daudz ir citu elektronu.
Atomu teorijā un kvantu mehānikā atoma orbitāle ir kvantu skaitlis. Katru šādu orbitāli var aizņemt viens vai divi elektroni. Orbitāļu izvietojums ir saistīts ar atomu elektronu konfigurācijām. Tās tika atvasinātas no agrīno spektroskopistu sniegtajiem dažu sārmu metālu spektroskopisko līniju aprakstiem kā asas, galvenās, izkliedētas un fundamentālas.
Kā orbitāles raksturo kvantu mehānikā
Orbitāles apraksta četri kvantu skaitļi:
- Galvenais kvantu skaitlis n — nosaka enerģijas līmeni (šeļļu) un orbitāles izmēru (n = 1, 2, 3 ...).
- Orbitālais (angl. azimuts) kvantu skaitlis l — nosaka subshell tipu un orbitāles formu (l = 0, 1, 2, ... n−1); l vērtības parasti apzīmē ar burtiem: s (l=0), p (l=1), d (l=2), f (l=3) u.c.
- Magnētiskais kvantu skaitlis m_l — nosaka orbitāles orientāciju telpā (m_l = −l ... +l); subshellā ir 2l+1 atsevišķas orbitāles.
- Spin kvantu skaitlis m_s — apraksta elektrona spinstāvokli (+1/2 vai −1/2). Katru orbitāli var aizņemt ne vairāk kā divi elektroni ar pretējiem spinam.
Orbitāļu formas un īpašības
Katra orbitaļes viļņu funkcija rada raksturīgu formu un virsmas, uz kurām varbūtība atrast elektronu ir augsta. Tipiskās formas:
- s-orbitāles — sfēriskas ap atomu kodolu.
- p-orbitāles — hanteles formas, orientētas pa dažādām asīm (trīs orientācijas: p_x, p_y, p_z).
- d- un f-orbitāles — sarežģītākas formas ar vairāk uzgaļiem; svarīgas pārejas metālu un retzemju elementu ķīmijā.
Orbitāļu enerģija nav atkarīga tikai no n, bet arī no l — tas nosaka periodisko tabulu un ķīmiskās īpašības. Enerģiju kārtību bieži apraksta ar n + l noteikumu (Aufbau princips), lai gan ir izņēmumi (piem., d- un s-orbitalu aizpildīšanās variācijas pārejas metālos).
Elektronu uzbūve, uzpildīšana un eksperimentālie pierādījumi
Katru orbitāli var aizņemt maksimums divi elektroni (saskaņā ar Pauli eksklūzijas principu). Elektronu izvietojumu subshellos nosaka arī Hunda noteikums: degenerate (vienādas enerģijas) orbitāles subshellā vispirms aizņem viens elektrons ar paralēliem spinam, pirms pāri veidojas.
Orbitāles un to enerģijas līmeņus apstiprina eksperimentāli, piemēram, ar atomu spektroskopiju (elektronu pārejas rada raksturīgas līnijas), fotoelektronu spektroskopiju un citiem kvantu mērījumiem.
Nozīme ķīmijā un molekulārajā fizikā
Orbitāles ir pamats, lai izprastu ķīmiskās saites: molekulārās orbitāles veidojas no atomu orbitāļu kombinācijām, un to aizpildījums nosaka molekulas stabilitāti, reaktivitāti un magnētiskās īpašības. Elektronu konfigurācija (piem., 1s² 2s² 2p⁶) paskaidro elementu ķīmiskās īpašības un vietu periodiskajā tabulā.
Vizualizācija un praktiskais pielietojums
Orbitāles parasti vizualizē kā virsmas, kurās varbūtība atrast elektronu ir, piemēram, 90%. Datoru kvantu ķīmijas programmas (piemēram, metodes, kas risina Šrēdingera vienādojumu) ļauj modelēt orbitāļu formas un enerģijas sarežģītām sistēmām — no atomi līdz lielām molekulām un materiāliem. Šie modeļi ir būtiski farmācijā, materiālzinātnē, katalīzē un elektronikas izpētē.
Kopsavilkums
Orbitāles nav šauras "trajektorijas", bet viļņu funkcijas, kas dod varbūtību, kur elektrons atradīsies. Tās raksturo kvantu skaitļi, nosaka elektronu konfigurācijas un ir centrālais jēdziens, lai saprastu atomu uzbūvi, spektroskopiju un ķīmiskās saites. Zināšanas par orbitālēm nodrošina pamatu mūsdienu ķīmijai un kvantu fizikā.
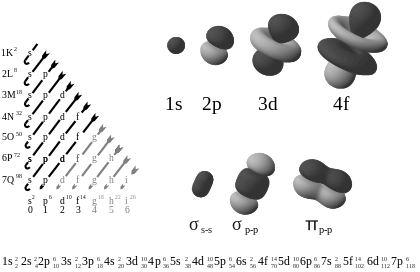
Diagrammā pa kreisi ir attēlotas orbitāles pieaugošās enerģijas secībā. Labajā pusē ir orbitāļu formu piemēri.
Saistītās lapas
- Elektronu mākonis
- Molekulārā orbitāle
Jautājumi un atbildes
J: Kas ir atomu orbitāles?
A: Atomārās orbitāles ir apgabali ap atoma kodolu, kuros visdrīzāk var atrasties elektroni.
J: Kāda ir matemātiskā funkcija, kas apraksta elektronu uzvedību atomā?
A: Matemātiskā funkcija, kas apraksta elektronu uzvedību atomā, ir viļņveida funkcija.
J: Kāpēc tiek lietots vārds "orbitāle"?
A: Vārdu "orbitāle" lieto, lai aprakstītu apgabalus ap kodolu, kuros visdrīzāk ir sastopami elektroni, jo kādreiz uzskatīja, ka elektroni uzvedas kā planētas, kas riņķo ap sauli.
J: Kā nosaka atomu orbitāļu skaitu elementā?
A: Atomu orbitāļu skaitu elementā nosaka pēc elementa perioda.
J: Kāpēc elektroni pārvietojas starp orbitālēm?
A: Elektroni pārvietojas starp orbitālēm atkarībā no to ātruma un citu klātesošo elektronu skaita.
J: Kas ir atoma orbitāle atomu teorijā un kvantu mehānikā?
A: Atoma orbitāle ir kvantu skaitlis atomu teorijā un kvantu mehānikā.
J: Cik elektronu var ieņemt katra atoma orbitāle?
A: Katru atoma orbitāli var aizņemt viens vai divi elektroni.
Meklēt