Konjugētā sistēma (ķīmija): definīcija, delokalizētie π-elektroni un piemēri
Uzzini, kas ir konjugētā sistēma ķīmijā — definīcija, delokalizētie π-elektroni, īpašības un ilustrēti piemēri no molekulām, grafīta un vadošiem polimēriem.
Ķīmijā konjugēta sistēma ir savienotu p-orbitāļu sistēma ar delokalizētiem elektroniem. Konjugētas sistēmas veido vairākas daudzkārtējas saites, no kurām katra atdalīta ar vienkāršām saitēm (pi–sigma–pi secība). Tādas sistēmas samazina molekulas kopējo enerģiju un palielina tās stabilitāti, jo pi elektroni var delokalizēties pa vairākām virknēm un atomiem. Konjugētās sistēmās var piedalīties arī vientuļos pāri, radikāļi vai karbēnija joni — to saimniekošana pa sistēmu papildus stabilizē jonu vai radikāļu formu. Savienojumi ar konjugācijām var būt cikliski, acikliski, lineāri vai jaukti; atomus molekulā parasti tur kopā vienkāršas saites, kur blakus esošo atomu orbitāles pārklājas, ļaujot p-orbitāļu mijiedarbībai.
Conjugation is the overlap of one p-orbital with another across a sigma bond (or single bond) that is in between. (Lielāku atomu d-orbitāles arī var veidot konjugētu sistēmu.) Šī p-orbitāļu pārklāšanās nodrošina kopīgu pi-elektronu mākoni virs un zem sānu ķēdes, tādā veidā elektroni nepieder vienai konkrētai saitei vai atomam, bet gan visa skaita atomu grupai.
Delokalizētie π-elektroni un rezonanse
Konjugētā sistēmā ir p-orbitāļu pārklāšanās apgabals, kas savieno starp tām esošās vienkāršās saites. Tie ļauj pi elektroniem delokalizēties p-orbitālēs, kas atrodas blakus. Pi elektroni nepieder vienai saitei vai atomam, bet gan atomu grupai; šī delokalizācija bieži tiek attēlota, izmantojot rezonanses (rezonējošas) struktūras, kurās elektronu blīvums ir izkliedēts pāri vairākiem atomiem. Rezonanses apraksts palīdz saprast, kā elektroniskā blīvuma pārdale samazina potenciālo enerģiju un rada vidējus saites garumus (bond length equalization) starp vienkāršo un dubulto saiti vērtībām.
Aromātiskums un Hückel likums
Speciāla konjugācijas forma ir aromātiskums — slēgta cikliska konjugācija, kas sniedz papildus stabilitāti, ja sistēmā ir noteikts elektronu skaits. Parasti to raksturo Hückel noteikums: cikliskiem, plakanajiem, konjugētajiem pi-sistēmām ir īpaša stabilitāte, ja tajās ir 4n+2 delokalizētu pi-elektronu (kur n ir vesels skaitlis). Tipisks aromātisks piemērs ir benzēns, kur sešu pi-elektronu delokalizācija rada izteiktu stabilitāti un īpašas ķīmiskas īpašības (piem., aizvietojumu reakcijas priekšrocība pār pievienošanas reakcijām).
Īpašības un ietekme uz fizikālajām/ķīmiskajām īpašībām
- Stabilitāte: konjugācija stabilizē jonu un radikāļu starpposmus (piem., allylic/benzylic karbokatjoni un radikāli).
- Reaktivitāte: α,β-nepiesātinātām sistēmām (konjugētiem karboniliem) raksturīgas nukleofīlas konjugācijas reakcijas un Michael pievienošanās.
- Spektrālās īpašības: konjugētām sistēmām samazinās enerģijas gap starp HOMO un LUMO, kas noved pie sarkanāka (bathohromiskā) UV–Vis absorbēšanas loka ar sistēmas pagarināšanos — tāpēc konjugēti savienojumi bieži ir krāsaini (piem., beta-karotīns).
- Elektriskā vadība: garas, delokalizētas konjugācijas ķēdes (polimēri kā poliacetilēns, grafīts, grafīts, vadošie polimēri) veicina elektronu kustību pa sistēmu; to pašu īpašību izmanto organiskajās pusvadītāju ierīcēs.
- Fizikālas īpašības: konjugācija ietekmē saites garumu un molekulas geometriju — bieži novērojama saites garumu vienādošanās starp vienkāršajām un dubultajām saitēm.
Piemēri
- 1,3-butadīns — vienkāršs lineārs 1,3-konjugēts dienes piemērs, kur pi elektroni delokalizējas pāri četratoma ķēdei.
- Benzēns — cikliska aromātiska sistēma ar sešiem delokalizētiem pi-elektroniem; klasisks aromātiskuma piemērs.
- Konjugēti karbonili — piemēram, α,β-nepiesātināti aldehīdi un ketoni (enoni), kuru reakcijas profilus diktē konjugācija.
- Poliēni un citi konjugēti polimēri — materiāli ar mainītām optiskajām un elektriskajām īpašībām, ko izmanto organiskajās elektronikās.
- Lielas konjugētas sistēmas — tieši parādās grafītā, vadošajos polimēros un oglekļa nanocaurulītēs, kur delokalizēto elektronu tīkls nodrošina izcilas vadītspējas un optiskās īpašības.
Krustpunkti ar citiem konceptiem
Konjugācija saistās ar daudzām ķīmijas tēmām: rezonansi, aromātiskumu, elektronisku struktūru (HOMO/LUMO), un materiālu zinātni. Praktiski tās ietekmi izmanto krāsvielu, polimēru, pusvadītāju un farmaceitisko molekulu projektēšanā. Sapratne par konjugāciju palīdz paredzēt reakciju ceļus, molekulāro stabilitāti un fizikālās īpašības.
Izmantojiet konjugācijas principus, lai skaidrotu, kā konkrētas molekulas reaģē un kāpēc tām ir noteikta krāsa, stabilitāte vai vadītspēja; salīdzinoši vienkārša pi-orbitāļu pārklāšanās var radikāli mainīt molekulas uzvedību.

Cinnamaldehīds, fenola savienojuma veids ar konjugētu sistēmu
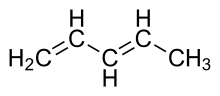
1,3-pentadiēns
Mehānisms
Konjugāciju var izraisīt dažāda veida molekulārās struktūras. Konjugācijas gadījumā visiem ķēdes blakus esošajiem atomiem jābūt pieejamai p-orbitālei. Daudzos gadījumos konjugētās sistēmas ir virkne vienkāršo saišu, no kurām katrai seko dubultā saite. Pastāv arī citas sistēmas. Piemēram, furāns (sk. attēlu) ir piecu elementu gredzens ar divām pārmaiņus dubultsaitēm un skābekli 1. pozīcijā. Skābeklim furānā ir divi vientuļie pāri, no kuriem viens aizpilda p-orbitāli šajā pozīcijā. Vienīgais elektronu pāris nodrošina konjugāciju piecu locekļu gredzenā. Slāpekļa klātbūtne gredzenā var būt konjugācijai nepieciešamo pi orbitāļu avots. Konjugācijai nepieciešamās pi orbitāles var nākt arī no α aizvietotājgrupām, piemēram, karbonilgrupas (C=O), imīna grupas (C=N), vinila grupas (C=C) vai anjona.
Hromofori
Galvenās hromoforus veido konjugētas sistēmas. Hromofori ir gaismu absorbējošas molekulas daļas, kas savienojumam var piešķirt redzamu krāsu. Hromofori bieži ir dažādos organiskajos savienojumos, un dažkārt tie ir polimēros, kas ir krāsaini vai spīd tumsā. Hromoforus bieži veido virkne konjugētu saišu un/vai gredzenu sistēmu, kas var ietvert C-C, C=C, C=O vai N=N saites. Daudzos gadījumos hromoforiem ir aromātiski gredzeni.
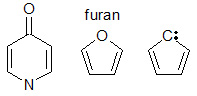
Konjugācija ar dažāda veida p-orbitālu donorgrupām
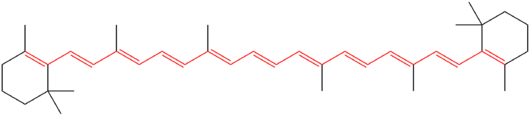
Beta-karotīna ķīmiskā struktūra. Vienpadsmit konjugētās dubultsaites, kas veido molekulas hromoforu, ir izceltas sarkanā krāsā.
Bieži piemēri
Saistītās lapas
- Rezonanse (ķīmija)
- Hiperkonjugācija
- Krusteniskā konjugācija
- Poliēns
Jautājumi un atbildes
J: Kas ķīmijā ir konjugētā sistēma?
A: Konjugēta sistēma ir sistēma, kas sastāv no nepārtrauktām un paralēlām p-orbitālēm ar delokalizētiem elektroniem.
J: Kā tiek radītas konjugētās sistēmas?
A: Konjugētas sistēmas veido vairākas daudzkārtējas saites, no kurām katru atdala viena saite.
J: Ko var atrast konjugētā sistēmā?
A: Konjugētās sistēmās var būt vientuļie pāri, radikāļi vai karbonija joni.
J: Vai savienojums ar konjugētu sistēmu var būt ciklisks?
A: Jā, savienojums ar konjugētu sistēmu var būt ciklisks, aciklisks, lineārs vai jaukts.
J: Kādas ir unikālās īpašības molekulām ar konjugētu sistēmu?
A: Molekulām ar konjugētu sistēmu ir unikālas īpašības, kas atšķiras no parastiem savienojumiem, ko rada delokalizēto elektronu sadale starp daudziem atomiem.
J: Kāda ir konjugācijā iesaistītā pārklāšanās?
A: Konjugācija ir vienas p-orbitāles pārklāšanās ar citu p-orbitāli, kas atrodas starp tām, izmantojot sigma saiti (vai vienu saiti).
J: Kur ir lielākās konjugētās sistēmas?
A: Lielākās konjugētās sistēmas (ar lielāko kopīgo elektronu skaitu) ir grafītā, vadošos polimēros un oglekļa nanocaurulītēs.
Meklēt