Benzēns (benzols, C6H6) — īpašības, lietojumi un veselības riski
Benzēns (C6H6) — īpašības, lietojumi un veselības riski. Uzzini par tā ķīmiju, industrijas pielietojumiem, kancerogenitāti un drošības pasākumiem.
Benzols, pazīstams arī kā benzols, ir organisks ķīmisks savienojums ar formulu 6CH6. Tas ir bezkrāsains un viegli uzliesmojošs šķidrums ar saldu smaržu. Benzola molekulas ir gredzens no sešiem oglekļa atomiem, kas katrs ir saistīts ar vienu ūdeņraža atomu. Tas ir aromātisks savienojums, kas nozīmē, ka gredzenam ir mainīgas dubultās saites.
Benzols ir kancerogēns, kas nozīmē, ka tas var izraisīt vēzi. Tam ir daudz reālu pielietojumu. To izmanto kā piedevu benzīnam, plastmasai, sintētiskajam kaučukam, krāsvielām, un tas ir rūpniecisks šķīdinātājs, kas nozīmē, ka tas var izšķīdināt daudzas citas ķīmiskas molekulas. Benzols ir arī dabiska jēlnaftas sastāvdaļa, tāpēc tas ir benzīna sastāvā. Daudzu zāļu sastāvā ir no benzola izgatavotas daļas.
Fizikālās un ķīmiskās īpašības
- Stāvoklis: bezkrāsains, eļļains šķidrums istabas temperatūrā.
- Smarža: salda, raksturīga aromātiska smarža (jutība smakai atšķiras starp cilvēkiem).
- Uzliesmojamība: viegli uzliesmojošs — tvaiki var veidot sprādzienbīstamas maisījumus ar gaisu.
- Šķīdība: praktiski nešķīst ūdenī, labi šķīst organiskos šķīdinātājos.
- Ķīmiskā īpašība: aromātiskais oglekļa gredzens dod benzolam raksturīgo stabilitāti, tomēr tas reaģē ar elektrofīliem papildinājumiem un oksidēšanos.
Kur benzols rodas un kā to ražo
- Dabā benzols sastopams jēlnaftā un tiek izdalīts no degšanas procesiem (piem., automašīnu izplūdes gāzes, ugunsgrēki).
- Rūpniecībā benzolu iegūst no naftas frakcionēšanas un no aromātu pārstrādes procesiem. To var iegūt arī sintētiski no acetilēna vai citiem izejmateriāliem.
Lietojumi
Benzols ir izejmateriāls daudzos rūpnieciskos procesos un produktos:
- Kā izejviela organisko savienojumu sintezē: krāsvielas, smaržvielas, detergenti, farmaceitiskie produkti.
- Kā rūpnieciskais šķīdinātājs organiskajām vielām (tomēr drošāki aizstājēji tiek izmantoti, jo benzols ir toksisks).
- Kā sastāvdaļa degvielā — benzīna frakcijās; daļēji tiek pievienots kā antidetonants vai aromāts, bet izmantošana tiek ierobežota veselības dēļ.
- Rūpnieciskās ķīmijas ražošanā: sintētiskā kaučuka, plastmasas, krāsvielu un dažu zāļu starpproduktu ražošana.
Veselības riski un toksikoloģija
Akūta iedarbība: īslaicīga lielu benzola tvaiku ieelpošana var izraisīt galvassāpes, reiboni, nelabumu, reibumu, miegainību un samaņas zudumu. Augstas koncentrācijas var bojāt centrālo nervu sistēmu un izraisa elpošanas traucējumus vai sirds darbības traucējumus.
Kroniska iedarbība: ilgstoša ekspozīcija (galvenokārt darbā) var bojāt kaulu smadzenes, izraisot anēmiju, leikopēniju un citus asinsainas traucējumus. Benzols ir saistīts ar paaugstinātu risku attīstīt akūtu mielolīzi vai akūtu mieloīdo leikēmiju (AML). Tā dēļ benzols tiek klasificēts kā kancerogēns.
Jutīgākās grupas: bērni, grūtnieces un cilvēki ar hematopoētiskās sistēmas traucējumiem var būt īpaši jutīgi pret benzola iedarbību.
Ekspozīcijas ceļi un vide
- Ieelpošana — visizplatītākais risks: benzola tvaiki ātri iekļūst asinīs un izplatās organismā.
- Ādas kontakts — var notikt uzsūkšanās caur ādu, īpaši ilgstošs kontakts vai šķidrumu izlijumi bez aizsardzības.
- Norīšana — reti, bet bīstami; var notikt darba vietās vai avārijas situācijās.
- Vides piesārņojums — benzols var iekļūt gruntsūdeņos un augsnē, ilgstoši ietekmējot ūdens kvalitāti un ekosistēmas.
Noteikumi, robežvērtības un drošības vadlīnijas
Daudzas valstis ir ieviesušas darba vides un vides robežvērtības benzola koncentrācijai gaisā un ūdenī. Darba vietās tiek prasīts samazināt ekspozīciju ar tehniskajiem pasākumiem, ventilāciju un personīgo aizsardzību. Pārbaudiet vietējos normatīvus un ieteikumus, jo robežvērtības un vadlīnijas var atšķirties.
Monitoring un analīze
Benzolu atklāj ar gāzu monitoriem, personīgajiem uzraudzības ierīcēm, kolorimetriskajām testu caurulītēm, un laboratorijas analīzēm (piem., gāzu hromatogrāfija ar masas spektrometriju). Regulāra monitoringa veikšana darba vietās un piesārņotās vides pārbaude palīdz novērst pārmērīgu iedarbību.
First aid un drošības pasākumi
- Ja ieliet vai uzkrita uz ādas: noņemt piesārņotu apģērbu un ātri nomazgāt ādu ar ūdeni un ziepēm; meklēt medicīnisku palīdzību, ja rodas kairinājums vai simptomi.
- Ja nokļuvis acīs: skalot acis ar tīru tekošu ūdeni vismaz 15 minūtes un nekavējoties meklēt medicīnisku palīdzību.
- Ja ieelpots: nogādāt personu svaigā gaisā, nodrošināt atpūtu; ja elpošana apstājas — veikt elpināšanu; sazināties ar neatliekamās medicīniskās palīdzības dienestu.
- Saindēšanās gadījumā ar norīšanu: nekavējoties zvanīt mediķiem; neizraisīt vemšanu, ja nav norādījuma no speciālista.
- Ugunsgrēka gadījumā: benzola liesmas slāpē ar putu, sausajiem ķīmiskajiem vai CO2 slāpētājiem; izvairīties no ūdens strūklas, kas var izplatīt izlieto vielu.
Samazināšana un aizstājēji
Rūpniecībā un laboratorijās tiek meklēti drošāki šķīdinātāji un izejvielas, lai aizstātu benzolu. Izmantošanas samazināšana, aizsargaprīkojums (respiratori, ķimikāliju izturīgs apģērbs) un tehniskie pasākumi (slēgtas sistēmas, ventilācija) būtiski samazina risku.
Secinājums
Benzols ir daudzpusīgs organiskais savienojums ar svarīgiem rūpnieciskajiem pielietojumiem, taču tas ir bīstams cilvēku veselībai un videi. Pareiza darba aizsardzība, rūpīga monitoringa prakse un alternatīvu izmantošana ir svarīgi, lai samazinātu ekspozīcijas riskus. Ja ir aizdomas par benzola iedarbību vai piesārņojumu, sazinieties ar veselības aprūpes speciālistu vai attiecīgajām vides/ darba aizsardzības institūcijām.
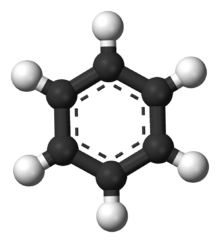
Benzola molekulas modelis. Oglekļa atomi attēloti melni, bet ūdeņradis - balts.
_1964,_MiNr_440.jpg)
1964. gadā Vācijas pasts izdeva pastmarku par godu benzola atklāšanas 100 gadu jubilejai.
Struktūra
Benzēnam piemīt īpašas īpašības, ko sauc par aromātiskumu. Visi seši oglekļa atomi gredzenā atrodas vienā plakancē. Lai veidotu visas saites sešu oglekļa savienojumu gredzenā, ir jābūt pārmaiņus dubultajām oglekļa saitēm (konjugētā sistēma):
Ja benzēnam būtu trīs dubultās saites, trīs tā gredzena malas būtu īsākas par pārējām trim malām. Rentgena staru difrakcija rāda, ka visas sešas benzola oglekļa-oglekļa saites ir vienāda garuma - 140 pikometru (pm). C-C saites garums ir lielāks nekā dubultās saites (135 pm), bet īsāks nekā vienkāršās saites (147 pm). Šis starpposma attālums atbilst elektronu delokalizācijai: C-C saites elektroni ir sadalīti vienādi starp katru no sešiem oglekļa atomiem. Molekula ir plakana. Viens no priekšstatiem ir tāds, ka struktūra eksistē kā tā saukto rezonanses struktūru superpozīcija, nevis katra no formām atsevišķi. (Citiem vārdiem sakot, molekulas dubultās saites ātri pārslēdzas starp oglekļa atomu pāriem.) Elektronu delokalizācija ir viens no benzola un radniecīgo aromātisko savienojumu termodinamiskās stabilitātes skaidrojumiem. Iespējams, ka šī stabilitāte veicina īpašās molekulārās un ķīmiskās īpašības, ko dēvē par aromātiskumu. Lai norādītu uz saites delokalizēto raksturu, benzols bieži tiek attēlots ar apli oglekļa atomu sešstūrainā izkārtojumā.
Kā tas ir ierasts organiskajā ķīmijā, oglekļa atomi diagrammā nav apzīmēti. Saprotot, ka katram oglekļa atomam ir 2p elektroni, katrs ogleklis ziedo elektronu delokalizētajā gredzenā virs un zem benzola gredzena. Tieši p orbitāļu pārklāšanās virs un zem gredzena rada pi mākoņus.
1986. gadā daži ķīmiķi žurnālā Nature publicētajā rakstā apstrīdēja delokalizācijas viedokli par benzolu. Viņi pierādīja, ka benzola elektroni gandrīz noteikti ir lokalizēti uz konkrētiem oglekļa atomiem. Viņi pierādīja, ka benzola aromātiskās īpašības rodas drīzāk spina sakabes, nevis elektronu delokalizācijas dēļ. Citi zinātnieki 1987. gadā rakstīja rakstus, kuros atbalstīja šo viedokli žurnālā Nature. Taču ķīmiķi lēni pārgāja no delokalizēto elektronu viedokļa.
Benzola atvasinājumi kā organisko molekulu sastāvdaļa sastopami pietiekami bieži, tāpēc blokā "Dažādi tehniskie" ir izveidots Unicode simbols ar kodu U+232C (⌬), kas apzīmē benzolu ar trim dubultsaitēm, un U+23E3 (⏣), kas apzīmē delokalizēto versiju.
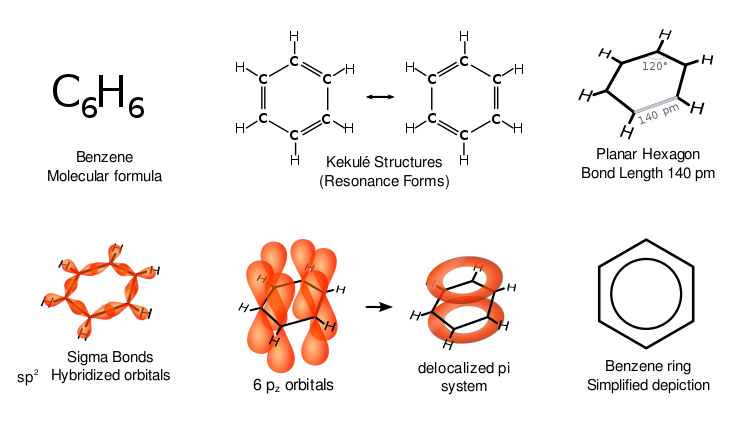
Dažādi benzola atveidojumi
Jautājumi un atbildes
J: Kas ir benzols?
A: Benzols ir organisks ķīmisks savienojums.
J: Kāda ir benzola ķīmiskā formula?
A: Benzola ķīmiskā formula ir C6H6.
J: Kāds ir benzola izskats un smarža?
A: Benzols ir bezkrāsains un viegli uzliesmojošs šķidrums ar saldu smaržu.
J: Kāda ir benzola molekulas struktūra?
A: Benzola molekula ir gredzens no sešiem oglekļa atomiem, kas katrs ir saistīts ar vienu ūdeņraža atomu. Tas ir aromātisks savienojums, kas nozīmē, ka gredzenam ir mainīgas dubultās saites.
Vai benzols ir kancerogēns?
A: Jā, benzols ir kancerogēns, tas nozīmē, ka tas var izraisīt vēzi.
J: Kādi ir daži reāli benzola izmantošanas veidi?
A: Benzolu izmanto kā piedevu benzīnam, plastmasai, sintētiskajam kaučukam, krāsvielām, un tas ir rūpniecisks šķīdinātājs, kas nozīmē, ka tas var izšķīdināt daudzas citas ķīmiskas molekulas. Daudzu zāļu sastāvā ir arī no benzola izgatavotas daļas.
J: Kur ir atrodams benzols?
A: Benzols ir dabiska jēlnaftas sastāvdaļa, tāpēc tas ir benzīna sastāvā.
Meklēt