Konrotācija un disrotācija: elektrocikliskas reakcijas un orbitalu simetrija
Konrotācija un disrotācija: dziļš ieskats elektrocikliskajās reakcijās, orbitalu simetrijā un Vudvarda-Hofmana noteikumos — termiski un fotoinducēti pārejas mehānismi un stereokemija.
Šie termini apraksta divas elektrociklisko reakciju (organisko ķīmisko reakciju veids) klases. Konjugētās dubultsaistes sistēmas galos esošie aizvietotāji kustas vienā un tajā pašā (pulksteņrādītāja rādītāja kustības) virzienā (pulksteņrādītāja kustības virzienā vai pretēji pulksteņrādītāja kustības virzienam) gredzena atvēršanas vai gredzena noslēgšanas laikā. Disrotācijas režīmā tie pārvietojas pretējos virzienos.
Kas ir konrotācija un disrotācija?
Elektrocikliskā reakcija ir periciliska reakcija, kurā konjugētā pi-elektronu sistēma cikliskā veidā atveras vai aizveras, veidojot vai laužot sigma saiti starp sistēmas galiem. Konrotācija nozīmē, ka galaplatņu p-orbitāles/grieznes rotē vienā virzienā (abi „pagriežas” vienādi), savukārt disrotācija — ka tās rotē pretējos virzienos (viena rotē pulksteņrādītāja virzienā, otra — pret to).
Orbitalu simetrija un reakcijas atļautība
Reakcijas stereorežīms (konrotācijas vai disrotācijas) nosaka elektroniskā struktūra — īpaši visaugstāk aizņemtā molekulārā orbitales (HOMO) fāžu izvietojums galos. Ja HOMO galos esošie pi orbitalu lobuli ir tādā fāžu attiecībā, ka to savienojumam nepieciešama viena virziena relatīvā rotācija, tad reakcija var notikt stereospecifiskā, „atļautā” režīmā bez orbitaļu simetrijas pārkāpuma. Pretējā gadījumā reakcija termiski būs „neatļauta” vai notiks ar augstāku enerģijas barjeru vai caur citiem ceļiem (piem., fotokemiju vai vairāku soli mehānismiem).
Kā piemēru var minēt trans-cis-trans-2,4,6-oktatriēna pārvēršanu cis-dimetilcikloheksadiēnā (attēlā augšā). Šīs reakcijas orbitālajai mehānikai ir nepieciešams disrotatorais režīms. Oktatriēna visaugstāk aizņemtās molekulārās orbitāles (HOMO) orbitāļu simetrijai ir nepieciešams, lai gala pi orbitāles kustētos pretējos virzienos, lai veidotu sigma saites pareizo simetriju.

Woodward–Hoffmann noteikumi un galvenās likumsakarības
Vudvarda-Hofmana noteikumi (Woodward–Hoffmann rules) apkopo, kā orbitalu simetrija nosaka, kurš režīms ir "atļauts" zema enerģijas ceļā. Galvenās likumsakarības elektrocikliskām reakcijām ir:
- Termiskām (siltuma inducētām) elektrocikliskām pārkārtošanām: sistēmām ar 4n + 2 pi elektroniem reakcija notiek disrotatorā režīmā; sistēmām ar 4n pi elektroniem — konrotatorā režīmā.
- Fotoinducētām (gaismas izraisītām) elektrocikliskām pārkārtošanām šīs attiecības ir apgrieztas: 4n + 2 sistēmām būs konrotatorais režīms, bet 4n sistēmām — disrotatorais.
Vienkāršāk sakot: termiski un fotokatalītiski gadījumi uzvedas pretēji, jo ekscitācijas maina, kura molekulārā orbitaļa ir HOMO vai LUMO un tāpēc mainās fāžu izkārtojums.
Paraugi un stereokimiskās sekas
- 6 pi (4n+2, n=1) piemērs: 1,3,5-hexatriene -> ciklisks cis- vai trans-1,3-cikloheksadiēns. Termiski tas parasti aizveras disrotatorā režīmā, un tas nosaka gala substituentu stereostereohēmiju (kāda būs attiecība starp substituentiem jaunizveidotajā ciklā).
- 4 pi (4n, n=1) piemērs: butadiēna sistēmas ciklisks slēgums/atvērums (piem., ciklobutena atvēršana) termiski notiek konrotatorā režīmā.
- Fotoinducētā reakcija: ja tieši fotonākscitācija pārnes elektronu citā orbitalē, HOMO un LUMO lomai mainoties, mainās arī „atļautais” rotācijas režīms un tāpēc var rasties pretējas stereokimiskās iznākas nekā termiskā ceļā.
Praktiska nozīme un pierādījumi
Šīs likumsakarības palīdz paredzēt un kontrolēt stereokīmiju organiskajās sintēzēs, īpaši ciklisku savienojumu veidošanā. Eksperimentāli konfigurācijas un stereospecifiskums tiek pārbaudīts, izmantojot produktu konfigurāciju, optisko aktivitāti, NMR, krāsu spektroskopiju un salīdzinot ar kvantuķīmijas aprēķiniem par orbitalu fāzēm un enerģijām. Ja reakcija notiek negaidītā režīmā, tas var liecināt par starpposma radikālu ceļu, fotoreakciju vai termisku apstākļu maiņu (piem., augstā temperatūrā vai katalizatoru klātbūtnē).
Kopsavilkums
Konrotācija un disrotācija ir divi stereorežīmi elektrocikliskajās reakcijās, kurus nosaka pi-elektronu skaits un orbitalu simetrija. Vudvarda-Hofmana noteikumi nodrošina sistēmu, pēc kuras var paredzēt, kurš režīms būs "atļauts" zema enerģijas ceļā: termiski 4n + 2 sistēmas parasti ir disrotatoras, 4n — konrotatoras; fotoinducētā gadījumā attiecības apgriežas. Šīs zināšanas ir būtiskas, plānojot stereoselektīvas organiskās sintēzes un izprotot pericilisko reakciju mehānismus.
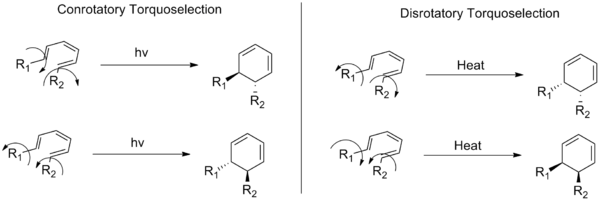
Konrotatorais un disrotatorais rotācijas režīms, kas parāda divus iespējamos rotācijas virzienus, kuru rezultātā veidojas enantiomēru pāri vispārīgai heksatriēna sistēmai.
Jautājumi un atbildes
J: Kas ir elektrocikliskā reakcija?
A: Elektrocikliskā reakcija ir organiskās ķīmiskās reakcijas veids, kurā konjugēto dubultsaišu sistēma atveras vai aizveras, veidojot gredzenu.
J: Kāda ir atšķirība starp konrotatorisko un disrotatorisko režīmu?
A: Konrotatoriskā režīmā konjugētās dubultsaistes sistēmas galos esošie aizvietotāji riņķa atvēršanas vai aizvēršanas laikā pārvietojas vienā un tajā pašā (pulksteņrādītāja rādītāja kustības) virzienā. Turpretī disrotācijas režīmā tie pārvietojas pretējos virzienos.
J: Kā orbitālā simetrija ietekmē šīs reakcijas?
A: Nosakot, vai reakcija notiek pēc konrotatoriem vai disrotatoriem noteikumiem, jāņem vērā reakcijas orbitāla mehānika. Piemēram, sistēmas, kas satur 4n + 2 pi elektronus, ir stereospecifiskas, un tām piemēro konrotatorijas likumu, jo to augstākajās aizņemtajās molekulārajās orbitālajās orbitālēs (HOMO) saglabājas orbitālu simetrija. Sistēmām, kas satur 4n pi elektronus, ir pretējs disrotatoriskais režīms. Tas attiecas arī uz 4n + 2 pi (kur n ir vesels skaitlis) elektronu pārkārtojumiem, ko izraisa gaisma (fotoinducēti). Fotoinducētas pārkārtošanās 4n pi elektronu sistēmās (kur elektronu skaits ir dalāms ar 4) notiek saskaņā ar disrotācijas likumu.
J: Kas ir Vudvarda-Hofmana noteikumi?
A: Vudvarda-Hofmana noteikumi apkopo dažādu veidu elektrocikliskās reakcijas un to, kā tās ietekmē tādi faktori kā orbitālu simetrija un gaismas enerģijas klātbūtne/trūkums.
J: Ko rāda šis attēls?
A: Attēlā ir parādīts trans-cis-trans-2,4,6-oktatriēna pārvēršanas par cis-dimetilcikloheksadiēnu piemērs, un tas ilustrē, kā aizvietotāji pārvietojas atšķirīgi atkarībā no tā, vai tas notiek konorotāri vai disrorotāri - attiecīgi pulksteņrādītāja kustības virzienā un pretēji pulksteņrādītāja kustības virzienam, skatoties no augšas.
Meklēt