Karbokations (karbokāts) — definīcija, struktūra un reaktivitāte
Karbokācijas (karbokāts) — skaidra definīcija, struktūra un reaktivitāte: uzzini sp2/sp3 hibridizāciju, stabilitāti, reakciju ceļus un piemērus organiskajā ķīmijā.
Karbokāts ir jons ar pozitīvi lādētu oglekļa atomu. Karbokācijas oglekļa atoms ir "sekstets" (tas ir, tā ārējā valences apvalkā ir tikai seši elektroni, nevis astoņi valences elektroni). Oglekļa atomiem ar astoņiem valences elektroniem ir maksimālā stabilitāte (okteta noteikums). Tāpēc karbokatjoni bieži ir reaktīvi, cenšoties aizpildīt valences elektronu oktetu, kā arī atgūt neitrālu lādiņu. Loģika teiktu, ka karbokācijai ir sp3 hibridizācija ar tukšu sp 3orbitāli, kas dod pozitīvu lādiņu. Tomēr karbokācijas reaktivitāte vairāk atgādina sp2 hibridizāciju ar trigonālo plakano molekulāro ģeometriju.
Struktūra un elektronu izvietojums
Klasiskais modelis: stabils karbokācijas modelis parasti attēlots kā oglekļa atoms ar sp2 hibridizāciju — trigonāla plakana ģeometrija, trīs sigma saites un tukša p orbitāle, kas satur nepāra (nepieciešamo) pozitīvo lādiņu. Tukšā p orbitāle ir perpendikulāra molekulas plaknei un ļauj elektronu delokalizāciju ar blakus esošajām dubultsaitēm vai aromātiskām sistēmām.
Stabilizācijas faktori:
- Hiperkonjugācija — alkilgrupu C–H saites var delokalizēt daļu labuma uz tukšo p orbitāli (t.i., metilēšanas efekts: terciāri > sekundāri > primāri > metils).
- Induktīvie efekti — alkilgrupu elektronu donējošas īpašības stabilizē karbokationu; elektronu atvelkoši substituenti to destablizē.
- Rezonsanses delokalizācija — allyl un benzylic karbokatjoni tiek ļoti stabilizēti, jo lādiņu iespējams izkliedēt pa vairākām atomu vietām.
- Heteroatomu ietekme — skābekļa vai slāpekļa nepāra elektronpāri var delokalizēt pozitīvo lādiņu (oksokarbonija, oksonija tipi), tomēr spēcīgi elektronegatīvi atomi vienlaikus var radīt inducētu vilkšanu.
- Solventi un pretjonu ietekme — polāri, jonizējoši šķīdēji un vāji koordinējoši anjoni (piem., BF4−, SbF6−) stabilizē brīvos karbokationus, pagarinot to dzīveslaiku.
Klasifikācija un piemēri
- Pēc sugas: primāri, sekundāri, terciāri karbokationi — stabilitātes secība parasti: terciāri > sekundāri > primāri > metils (bez stabilizējošiem efektiem).
- Rezonsanses stabilizētie: benzylic (fenilgrupas blakus), allylic (piem., allyl kations), oksokarbokationi (oxocarbenium) utt.
- Vinylic un aryl karbokatjoni: tie parasti ir ļoti nestabili, jo tukšā p orbitāle nevar efektīvi saskaņoties ar dubultsaiti vai aromātisko sistēmu bez zaudējuma aromātisma vai citām neizdevīgām konfigurācijām.
- Neparasti un “nekonvencionāli”: tādi kā 2-norborniliskais "non-classical" karbokations (diskutēta strukturāla delokalizācija, kur pozitīvais lādiņš tiek "izplatīts" pa tilta saišu tīklu).
Veidošanās ceļi
- Heterolītiska saišu pārrāvuma (piem., alkilhalīdu SN1 solvolīze).
- Alkēnu protonēšana elektrofilās pievienošanās reakcijās (piem., H+ pievienošana veido karbokāciju intermediatā).
- Dehidrēšana no spirtu (E1 mehānisms var iet caur karbokācijas starpposmu).
- Antikatjonu migrācijas vai oksidācijas/redukcijas procesi var radīt karbokationus.
Reaktivitāte un reakciju ceļi
Karbokatjoni ir spēcīgi elektrofiliski starpposmi, tāpēc galvenie ceļi ir:
- Nucleofilā uzbrukšana — ātra pievienošanās nucleofilam (piem., H2O, halogenīdi, alkoholi) noved pie adīcijas vai substitūcijas produktu veidošanās (SN1).
- Eliminācija — karbokācijas var deprotonēties, veidojot alkēnus (E1), bieži vadoties pēc Zaitseva noteikuma un produktu stabilitātes.
- Pārvietojumi (rearrangements) — hydride vai alkilgrupu pārvietojumi, lai veidotu stabilāku karbokationu (piem., sekundārs → terciārs). Šie pārvietojumi var būt ātri un ietekmēt galaproduktu sastāvu.
Eksperimentālie un spektrālie pierādījumi
Karbokatjonus bieži nevar tieši novērot istabas temperatūrā, taču tos var pētīt šādos veidos:
- Zema temperatūra NMR spektroskopijā, izmantojot "super-šķīdējus" vai ļoti polārus šķīdinātājus;
- Trapping (ķīmisko ķērienu izmantošana) ar ātrām nucleofilām reakcijām;
- Rokas un kinētikas pētījumi (SN1 ātrumu atkarība no substrāta un šķīdēja, Hammetta/Taft parametri), kas sniedz informāciju par starpposma dabas polaritāti;
- Spektri (IR, MS) un reaktivitātes testi pret vāji koordinējošiem anjoniem.
Teorētiskie aspekti un mācību punkti
Hammonda postulāts: reakciju pārejas stāvokļa struktūra atbilst starpposma stabilitātei — tas palīdz prognozēt, kuri intermediāti (piem., karbokationi) dominēs un kādus produktus sagaidīt. Praktiski tas nozīmē, ka stabilāks karbokations parasti rodas no lēnākas, endergoniskākas soļa daļas.
Praktiska nozīme: karbokācijas mehānismi ir pamatā daudziem organiskās ķīmijas procesiem — no alkēnu pievienošanās un alkoholu dehidrēšanas līdz reaģentu pārkārtojumam labiekārtotās sintēzēs. Sapratne par karbokāciju stabilitāti un uzvedību ļauj paredzēt produktu sastāvu un optimizēt reakcijas apstākļus.
Kopsavilkums
Karbokāts ir pozitīvi lādēts oglekļa starpposms, kurš parasti ir sp2 hibridizēts ar tukšu p orbitāli un plakanu ģeometriju. To stabilitāti ietekmē hiperkonjugācija, induktīvie efekti, rezonsanses delokalizācija un vides faktori (šķīdinātājs, pretjons). Reaktīvi ceļi ietver nucleofilā uzbrukumu, elimināciju un pārvietojumus; karbokacioni ir centrāli gan fundamentālajos mehānismos, gan praktiskās organiskās sintēzes reakcijās.
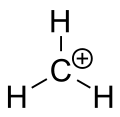
Metāna karbēnija jons

terc-butila katjonu, kas demonstrē plakanu ģeometriju
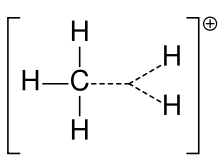
Metāna karbonija jons
Definīcijas
Agrāk karbokaciju bieži sauca par karbonija jonu, taču ķīmiķi apšauba precīzu nozīmi. Mūsdienu ķīmijā karbokacijs ir jebkurš pozitīvi lādēts oglekļa atoms. Ir ierosināti divi īpaši veidi: karbēnija joni ir trīsvērtīgi, bet karbonija joni ir piecvērtīgi vai sešvērtīgi. Universitātes līmeņa mācību grāmatās par karbokacijām runā tikai tā, it kā tās būtu karbēnija joni, vai arī karbokacijas tiek apspriestas ar īslaicīgu atsauci uz senāku frāzi par karbonija jonu vai karbēnija un karbonija joniem. Viena mācību grāmata līdz pat šai dienai paliek pie vecākā nosaukuma karbonija jons attiecībā uz karbēnija jonu, un frāzi hipervalents karbēnija jons patur CH5+.
Vēsture
1891. gadā G. Merlings ziņoja, ka viņš tropilidēnam (cikloheptatriēnam) pievienoja bromu un pēc tam produktu karsēja, lai iegūtu kristālisku, ūdenī šķīstošu materiālu C
7H
7Br. Viņš nepiedāvāja tā struktūru, tomēr Dērings un Nokss pārliecinoši pierādīja, ka tas ir tropililija (cikloheptatriēnija) bromīds. Saskaņā ar Hikla likumu šim jonam ir aromātisks raksturs.
1902. gadā Noriss un Kermans neatkarīgi atklāja, ka bezkrāsains trifenilmetanols koncentrētā sērskābē dod tumši dzeltenus šķīdumus. Trifenilmetilhlorīds līdzīgi veidoja oranžus kompleksus ar alumīnija un alvas hlorīdiem. Ādolfs fon Bejers 1902. gadā atzina, ka radušies savienojumi ir līdzīgi sālim.

Attiecību starp krāsu un sāļu veidošanos viņš nosauca par halohromiju, kuras spilgts piemērs ir malahīta zaļš.
Karbokatjoni ir reaktīvi starpprodukti daudzās organiskajās reakcijās. Šo ideju, ko 1899. gadā pirmo reizi ierosināja Jūlijs Štīglics, tālāk attīstīja Hanss Merveins (Hans Meerwein), 1922. gadā pētot Vāgnera un Merveina pārkārtošanos. Tika konstatēts, ka karbokatjoni ir iesaistīti arī NS1 reakcijā, E1 reakcijā un pārkārtošanās reakcijās, piemēram, Vitmora 1,2 nobīde. Ķīmijas nozares pārstāvji negribēja pieņemt jēdzienu "karbokācija", un ilgu laiku Amerikas Ķīmijas biedrības žurnāls atteicās publicēt rakstus, kuros tie tika pieminēti.
Pirmo stabila karbokācija NMR spektru šķīdumā 1958. gadā publicēja Dērings (Doering et al.). Tas bija heptametilbenzēnija jons, kas iegūts, apstrādājot heksametilbenzolu ar metilhlorīdu un alumīnija hlorīdu. Stabilo 7-norbornadienila katjonu 1960. gadā sagatavoja Story et al., reaģējot norbornadienila hlorīdam ar sudraba tetrafluoroborātu sēra dioksīdā -80 °C temperatūrā. Ar NMR spektru konstatēja, ka tas ir neklasiski savienots (pirmais novērotais stabilais neklasiskais jons).
1962. gadā Olahs ar kodolmagnētiskās rezonanses metodi tieši novēroja terc-butilkarbokatjonu kā stabilu sugu, izšķīdinot terc-butilfluorīdu burvju skābē. Par norbornīla katjonu NMR pirmo reizi ziņoja Šleiers (Schleyer et al.), un Saunderss (Saunders et al.) parādīja, ka tam notiek protonu skramblēšanās pāri barjerai.
Īpašības
Organiskajā ķīmijā karbokacijs bieži ir nukleofīlu, piemēram, hidroksila (OH−) jonu vai halogēnu jonu, nukleofīlā uzbrukuma mērķis.
Karbokatjonus atkarībā no oglekļa atomu skaita, kas saistīti ar jonizēto oglekli, klasificē kā primāros, sekundāros vai terciāros. Primārajiem karbokatjoniem ar jonizēto oglekli ir piesaistīts viens vai nulle ogļhidrātu, sekundārajiem karbokatjoniem ar jonizēto oglekli ir piesaistīti divi ogļhidrāti, bet terciārajiem karbokatjoniem ar jonizēto oglekli ir piesaistīti trīs ogļhidrāti.
Karbokācijas stabilitāte palielinās, palielinoties alkilgrupu skaitam, kas saistītas ar lādiņu nesošo oglekli. Trešie karbokatjoni ir stabilāki (un veidojas vieglāk) nekā sekundārie karbokatjoni; primārie karbokatjoni ir ļoti nestabili, jo, lai gan jonizētos augstākas kārtas oglekļus stabilizē hiperkonjugācija, nepiesaistītie (primārie) oglekļi nav stabilizēti. Tāpēc tādas reakcijas kā NS1 reakcija un E1 eliminācijas reakcija parasti nenotiek, ja veidojas primārais karbokāts. Izņēmums ir gadījumi, kad blakus jonizētajam ogleklim ir oglekļa-oglekļa dubultā saite. Tādi katjoni kā alila katjons CH=CH-CH22+ un benzila katjons6 CH-CH52+ ir stabilāki nekā lielākā daļa citu karbokatjonu. Molekulas, kas var veidot alila vai benzila karbokatjonus, ir īpaši reaktīvas.
Karboksikācijas notiek pārkārtošanās reakcijas no mazāk stabilām struktūrām uz tikpat stabilām vai stabilākām ar ātruma konstantām, kas pārsniedz 10/sek9. Šis fakts sarežģī daudzu savienojumu sintēzes ceļus. Piemēram, karsējot 3-pentanolu ar ūdens HCl, sākotnēji izveidojies 3-pentila karbokāts pārkārtojas uz statistisku 3-pentila un 2-pentila maisījumu. Šiem katjoniem reaģējot ar hlorīda jonu, veidojas aptuveni 1/3 3-hlorpentāna un 2/3 2-hlorpentāna.
Dažiem karbokatjoniem, piemēram, norbornīla katjonam, piemīt vairāk vai mazāk simetriska trīs centru saistība. Šādus katjonus dēvē par neklasiskiem joniem. Enerģētiskā atšķirība starp "klasiskajiem" karbokatjoniem un "neklasiskajiem" izomēriem bieži vien ir ļoti maza, un pārejā starp "klasisko" un "neklasisko" struktūru parasti ir neliela aktivācijas enerģija, ja tāda vispār ir. Neklasiskā" 2butila karbokācijas forma būtībā ir 2butilkarbokācija ar protonu tieši virs oglekļa-oglekļa dubultsaites centra. "Neklasiskie" karbokatjoni savulaik bija lielu strīdu objekts. Viens no Džordža Olaha lielākajiem ieguldījumiem ķīmijā bija šo pretrunu atrisināšana.
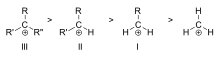
Tretikāro (III), sekundāro (II) un primāro (I) alkilkarbonātu stabilitātes piemēru secība
Specifiskie karbokatjoni
Ciklopropilkarbinilkarbonilkatjonus var pētīt ar NMR:

Dimetila atvasinājuma NMR spektrā abām metilgrupām ir konstatēti divi neekvivalenti signāli, kas norāda, ka šī katjona molekulārā konformācija nav perpendikulāra (kā A), bet gan divdaļīga (kā B) ar tukšo p-ornitāli un ciklopropila gredzena sistēmu vienā plaknē:

Saskaņā ar liekto saišu teoriju šī priekšroka ir izskaidrojama, pieņemot labvēlīgu orbitāļu pārklāšanos starp aizpildītajām ciklopropāna liektajām saitēm un tukšo p-orbitāliju.
Jautājumi un atbildes
J: Kas ir karbokācija?
A: Karbokacijs ir jons ar pozitīvi lādētu oglekļa atomu.
J: Kāda ir karbokācijas ārējā valences čaula?
A: Karbokācijas ārējā valences apvalkā ir tikai seši elektroni, nevis stabili astoņi valences elektroni.
J: Kāpēc karbokatjoni bieži ir reaktīvi?
A: Karbokatjoni bieži ir reaktīvi, jo tie cenšas aizpildīt valences elektronu oktetu, kā arī atgūt neitrālu lādiņu.
J: Kāda ir oglekļa atomu maksimālā stabilitāte?
A. Oglekļa atomu maksimālā stabilitāte ir tad, ja tiem ir astoņi valences elektroni.
J: Kas ķīmijā ir sekstets?
A: Sekstets ir termins, ko lieto, lai aprakstītu oglekļa atomu karbokācijā, kura ārējā valences apvalkā ir tikai seši elektroni, nevis stabili astoņi valences elektroni.
J: Kāda ir karbokācijas hibridizācija un molekulārā ģeometrija?
A: Lai gan loģika liek domāt, ka karbokatjoniem ir sp3 hibridizācija ar tukšu sp3 orbitāli, kas dod pozitīvu lādiņu, to reaktivitāte vairāk atgādina sp2 hibridizāciju ar trigonāli plakanu molekulāro ģeometriju.
J: Kas ir okteta likums?
A: Okteta noteikums ir princips ķīmijā, kas nosaka, ka atomiem ir tendence veidot ķīmiskās saites ar citiem atomiem, kas ļauj abiem atomiem iegūt stabilu astoņu valences elektronu kopumu.
Meklēt