Cheletropiskās reakcijas — definīcija, mehānisms un piemēri
Cheletropiskās reakcijas — skaidrojums, mehānisms un ilustrēti piemēri. Uzzini periciklisko procesu, viena atoma saišu veidošanos un heletropiskās ekstrūzijas.
Cheletropiskās reakcijas ir periciklisko reakciju veids, kad viens atoms vienā no reaģentiem iegūst divas jaunas saites. Pericikliska reakcija ir tāda reakcija, kas ietver pārejas stāvokli ar ciklisku atomu masīvu un ar to saistītu ciklisku mijiedarbības orbitāļu masīvu. Šajā cikliskajā masīvā notiek σ un π saišu reorganizācija.
Cheletropiskās reakcijas ir cikloadīciju apakšklase. Cheletropiskās reakcijas atšķiras ar to, ka vienā no reaģentiem abas jaunās saites tiek veidotas ar vienu un to pašu atomu. Daži piemēri ir parādīti 1. attēlā pa labi. Pirmajā gadījumā vienīgais atoms ir oglekļa atoms karbonilgrupā. Šis oglekļa atoms nonāk oglekļa monoksīdā. Galarezultātā tiek izveidotas divas jaunas saites ar vienu atomu. Pirmie divi piemēri ir pazīstami kā "heletropiskās ekstrūzijas", jo reakcijas laikā izdalās maza stabila molekula. Šo reakciju virzītājspēks bieži vien ir entropiskais ieguvums no gāzes (piemēram, CO vai N2) izdalīšanās.
Mehānisks skaidrojums
Cheletropiskās reakcijas parasti norisinās kā pericikliski, koncerēti procesi, kuros vienlaikus tiek veidotas (vai lauztas) divas saites uz viena atoma. No orbitālu viedokļa tās var tikt aprakstītas ar ciklisku mijiedarbību starp reaģentu π-orbitālēm un vienas reaktanta divvalentu atoma (piem., karbena vai sēra) orbitālēm. Frontier molecular orbital (FMO) skatījumā svarīgas ir divas mijiedarbības: viena, kurā pilna orbitāla no viena reaktanta sadarbojas ar tukšu orbitālu otra reaktanta, un otrā, kurā notiek elektronu pārvietojums pretēja virzienā. Singletā karbena gadījumā, kur ir gan viena pilna (lone pair), gan viena tukša p-orbitāla, abas šīs mijiedarbības var notikt vienlaikus, veicinot koncerētu divu saišu izveidi.
Woodward–Hoffmann noteikumi nosaka, kuri cheletropiskās pievienošanās veidi ir simetrijiski atļauti kā suprafaciāli vai antarafaciāli procesi atkarībā no iesaistīto π-elektronu skaita un pieejamajām orbitālu simetrijām. Reakcijas stereokemija (piem., vai pievienošanās notiek vienlaikus un sinhroni) var atšķirties — daudzas cheletropiskās pievienošanās ir stereospecifiskas un notiek syn virzienā, kamēr dažas var norisināties asimptomātiski vai solis-pa-solim, it īpaši ja iesaistīti tripletie karbeni vai radikālu starpprodukti.
Stereokemija un singleta vs tripleta karbeni
Praktiski svarīgs aspekts ir, vai pievienojamais atomu fragments ir singlets vai triplets. Singletie karbeni parasti reaģē koncerēti un stereospecifiski — alkēna konfigurācija tiek saglabāta (cis → cis, trans → trans) un abu saišu veidošanās notiek no vienas puses (syn). Tripletie karbeni biežāk reaģē caur stepwise radikālu mehānismu, kas var novest pie stereokemiskas izmaiņas vai racemizācijas.
Tipiski piemēri
- Ciklopropanācijas ar karbeni: pievienošanās :CH2 vai halogēnētu karbenu (piem., :CCl2) pie alkēna, veidojot ciklopropānu. Šīs reakcijas bieži uzskatāmas par cheletropiskām (2+1 cikloadīcija). Praktiskie piemēri — diazometāna vai diazo savienojumu ģenerēšana un karbenu pievienošana, kā arī Simmons–Smith reakcija (jodomētilzinka intermediāts), kas izmanto metālu karbenoīdus.
- SO2 pievienošanās un ekstrūzija: konjugētiem diviēnām SO2 var koncerēti pievienoties, veidojot sulfolēnus; reversā reakcijā (ekstrūzijā) iespējams izvadīt SO2 gāzi. Šīs reakcijas ir svarīgas gan sintēzēs, gan kā termodiagnostisks piemērs cheletropiskai ekstrūzijai.
- N2 ekstrūzija no diazo savienojumiem: kad diazo savienojums reaģē ar alkēnu, bieži notiek spontāna N2 atbrīvošanās un karbena pievienošanās, kas kopumā izskatās kā cheletropiska reakcija, kur viena no reakcijas partnerēm galu galā tiek atbrīvota kā gāze (N2).
- Metālkompleksu ekstrūzijas: no organometāliskajiem savienojumiem var tikt izvadīti CO vai citi mazi ligandāri molekuli, kas ir cheletropiskas ekstrūzijas piemērs, īpaši piedaloties pārejas metālu centru reorganizācijai.
Enerģētika un kinētika
Cheletropisko reakciju termodinamika un kinetika ir atkarīga no vairākiem faktoriem: saišu stipruma, elektronikām, slāpekļa/oglekļa diatomu stabilitātes (ja tiek atbrīvota N2 vai CO), kā arī entropiskā faktora, kad reakcijā izdalās gāze. Ekstrūzijas, kurās rodas gāze (piem., CO, N2, SO2), bieži ir entropiski veicinātas un var norisināties vieglāk pat ja entalpijas izmaiņa nav ļoti liela. Katalītiski aktivizēti ceļi (piem., metālu katalizatori karbenu transfertiem) var samazināt reakcijas aktivācijas enerģiju un uzlabot selektivitāti.
Eksperimentāli pierādījumi un diagnostika
Lai noteiktu, vai reakcija ir koncerēta cheletropiska vai notiek caur posmu starpproduktiem, izmanto dažādus paņēmienus:
- stereokemiskie testi (saglabājas vai mainās alkēna konfigurācija);
- trapu eksperimenti (radikālu skavotāji, O2 uztver faktu par radikālu starpproduktiem);
- kinētikas mērījumi un izotopu efekti (kuru novērojumi liecina par vienlaicīgu saišu veidošanos vai par starpproduktiem);
- teorētiskās (kvantķīmijas) aprēķini, kas modelē pārejas stāvokļus un orbitālu mijiedarbības.
Praktiskā nozīme
Cheletropiskās reakcijas ir lietderīgas organiskajā sintēzē — ciklopropānu iegūšana ir svarīga stratēģija bioaktīvu molekulu un sintētisku intermediatīvu sagatavošanā. Ekstrūzijas, kas atbrīvo mazas gāzveida molekulas, tiek izmantotas gan kā termiski virzītas reakcijas posmi, gan kā viļņi retrosintētiskās plānošanas gaitā.
Noslēgums
Kopumā cheletropiskās reakcijas ir īpatnējs periciklisks process, kurā viens atoms veido vai lauž divas saites vienlaikus. To izpratne prasa orbitālu simetrijas, FMO mijiedarbību un stereokemisko rezultātu analīzi. Eksperimentāli šīs reakcijas parasti raksturojas ar augstu stereospecificitāti, ja iesaistīti singleti fragmenti, un ar entropisku virzītājspēku ekstrūzijām, ja reakcijā atbrīvojas gāze (piem., CO, N2, SO2).

1. attēls. Pericikliskās reakcijas
Teorētiskā analīze
Ņemot vērā heletropiskajās reakcijās iesaistīto molekulu ģeometriju, tās apstiprina virkni teorētisko ķīmiķu prognožu. Cheletropiskās reakcijas apstiprina molekulāro orbitāļu simetrijas saglabāšanu.
Pericikliskā pārejas stāvoklī maza molekula ziedo gredzenam divus elektronus. Reakciju var izskaidrot ar divām iespējamām ģeometrijām. Mazā molekula var pietuvoties lineārā vai nelineārā veidā. Lineārās tuvināšanās gadījumā elektroni mazās molekulas orbitālē ir vērsti tieši uz lielās molekulas π sistēmu. Nelineārās pieejas gadījumā orbitāle pietuvojas nedaudz no leņķa. π sistēmas spēja rotēt, tuvojoties mazajai molekulai, ir izšķiroša jaunu saišu veidošanā. Rotācijas virziens būs atšķirīgs atkarībā no tā, cik π-elektronu ir sistēmā. Turpmāk ir parādīta diagramma, kurā redzams, kā divu elektronu fragments tuvojas četru elektronu π-sistēmai, izmantojot pierobežas molekulārās orbitāles. Rotācija būs disrotatoriska, ja mazā molekula tuvojas lineāri, un konrotatoriska, ja molekula tuvojas nelineāri. Disrotatoriskā un konrotatoriskā rotācija norāda, kā rotē π-sistēmas saites. Disrotācija nozīmē pretējos virzienos, bet konrotācija nozīmē to pašu virzienu. Tas ir parādīts arī diagrammā turpmāk.
Izmantojot Hakela likumu, var noteikt, vai π-sistēma ir aromātiska vai anti-aromātiska. Ja tā ir aromātiska, tad lineārās pieejās izmanto disrotācijas kustību, bet nelineārās - konrotācijas kustību. Pretēji ir ar antiaromātisku sistēmu. Lineārās pieejas izmantos konrotatorisko kustību, bet nelineārās - disrotatorisko kustību.
Cheletropiskās reakcijas, kurās iesaistīts SO2
Termodinamika
Sēra dioksīdam reaģējot ar butadiēnu un izoprēnu, rodas divi dažādi produkti. Reakcijas mehānisms nosaka, kas rodas. Iespējams gan kinētiskais produkts, gan termodinamiskais produkts. Termodinamiskā produkta rodas vairāk nekā kinētiskā produkta. Kinētiskais produkts rodas Dilsa-Aldera reakcijas rezultātā, bet heletropiskās reakcijas rezultātā rodas termodinamiski stabilāks produkts. Šeletropiskais ceļš tiek izmantots vairāk, jo tā rezultātā veidojas stabilāks piecu gredzenu savienojums. Tālāk redzamajā shēmā parādīta abu produktu atšķirība. Ceļš pa kreisi rāda termodinamisko produktu, bet ceļš pa labi rāda kinētisko produktu. Suaress un Sordo to parādīja 1995. gadā. Viņi to parādīja gan ar eksperimentiem, gan izmantojot Gausa aprēķinus.
Kinetika
Viens no piemēriem ir 1,3-diēnu heletropiskās reakcijas ar sēra dioksīdu. Ķīmiķi ir rūpīgi izpētījuši šīs reakcijas kinētiku. Isaacs un Laila 1976. gadā izmērīja sēra dioksīda pievienošanas butadiēna atvasinājumiem kinētiskos koeficientus. Pievienošanas ātrumu novēroja benzolā 30 °C temperatūrā ar sākotnējo divdesmitkārtīgu diēna pārpalikumu. Lai izmērītu SO2 izzušanu, viņi izmantoja spektrofotometru, pētot gaismu pie 320 nm. Reakcija uzrādīja "pseidopirmā loka kinētiku". Ķīmiķi konstatēja, ka elektronus atgrūstošās grupas uz djena samazina reakcijas ātrumu. Tāpat reakcijas ātrumu ievērojami ietekmēja 2-substituentu steriskais efekts, jo lielgabarīta grupas palielināja reakcijas ātrumu. (Citiem vārdiem sakot, jo lielāka atomu grupa karājās no otrā oglekļa atoma, jo reakcija noritēja ātrāk). Autori to skaidro ar lielgabarīta grupu tendenci veicināt diēna cisoidālo konformāciju, kas ir būtiska reakcijai (sk. tabulu turpmāk). Turklāt septiņiem diēniem tika izmērīti ātrumi četrās temperatūrās. Pēc šiem mērījumiem ķīmiķi izmantoja Arrēniusa vienādojumu, lai aprēķinātu katras reakcijas aktivācijas entalpiju (ΔH‡) un aktivācijas entropiju (ΔS‡). Tas bija viens no pirmajiem nozīmīgajiem centieniem izpētīt heletropisko reakciju kenetiku.
| -Butadiēns | 104 k /min−1 (30 °C) (± 1-2%) absolūts | 104 k /min−1 (30 °C) (± 1-2%) relatīvā | ΔH ‡/kcal mol−1 | ΔS ‡/cal mol−1 K −1 |
| 2-metil 2-metil | 1.83 | 1.00 | 14.9 | -15 |
| 2-etils | 4.76 | 2.60 | 10.6 | -20 |
| 2-izopropils | 13.0 | 7.38 | 12.5 | -17 |
| 2-terc-butil- | 38.2 | 20.8 | 10.0 | -19 |
| 2-neopentils | 17.2 | 9.4 | 11.6 | -18 |
| 2-cloro | 0.24 | 0.13 | NAV PIEMĒROJAMS | NAV PIEMĒROJAMS |
| 2-bromoetils | 0.72 | 0.39 | NAV PIEMĒROJAMS | NAV PIEMĒROJAMS |
| 2-p-tolil | 24.7 | 13.5 | 10.4 | -19 |
| 2-fenil | 17.3 | 9.45 | NAV PIEMĒROJAMS | NAV PIEMĒROJAMS |
| 2-(p-bromfenil) | 9.07 | 4.96 | NAV PIEMĒROJAMS | NAV PIEMĒROJAMS |
| 2,3-dimetil 2,3-dimetil | 3.54 | 1.93 | 12.3 | -18 |
| cis-1-metils | 0.18 | 0.10 | NAV PIEMĒROJAMS | NAV PIEMĒROJAMS |
| trans-1-metil | 0.69 | 0.38 | NAV PIEMĒROJAMS | NAV PIEMĒROJAMS |
| 1,2-dimetilēncikloheksāns | 24.7 | 13.5 | 11.4 | -16 |
| 2-metil-1,1,1,4,4,4-d4 | 1.96 | NAV PIEMĒROJAMS | NAV PIEMĒROJAMS | NAV PIEMĒROJAMS |
Monnats, Vogels un Sordo 2002. gadā veica sēra dioksīda pievienošanas 1,2-dimetilidēncikloalkāniem kinētikas mērījumus. Viņi rakstīja, ka 1,2-dimetilidenecikloheksāna reakcijā ar sēra dioksīdu atkarībā no reakcijas apstākļiem var rasties divi dažādi produkti. Reakcijas laikā, kinētiski kontrolējot (≤ -60 °C), rodas atbilstošais sultīns, izmantojot hetero-Dilsa-Aldera reakciju, bet termodinamiski kontrolējot (≥ -40 °C), reakcijas laikā, izmantojot heletropisko reakciju, rodas atbilstošais sulfolēns. Aktivācijas entalpija hetero-Dilsa-Aldera reakcijai ir par aptuveni 2 kcal/mol mazāka nekā attiecīgajai heletropiskajai reakcijai. Sulfolēns ir par aptuveni 10 kcal/mol stabilāks nekā izometriskais sultīns CHCl/SO222 šķīdumā.
Autoriem izdevās eksperimentāli noteikt ātruma likumu 261,2 K temperatūrā 1,2-dimetilidenecikloheksāna reakcijai ar sēra dioksīdu, lai iegūtu attiecīgo sulfolēnu. Reakcija bija pirmās kārtas 1,2-dimetilidenecikloheksānam, bet otrās kārtas sēra dioksīdam (sk. turpmāk). Tas apstiprināja teorētisko ķīmiķu prognozi, kas balstīta uz augsta līmeņa ab initio kvantu aprēķiniem. Izmantojot skaitļošanas metodes, autori ierosināja 1,2-dimetilidēnecikloheksāna heletropiskās reakcijas ar sēra dioksīdu pārejas struktūru (skatīt attēlu labajā pusē). Reakcija ir otrās kārtas reakcija ar sēra dioksīdu, jo cita sēra dioksīda molekula, iespējams, saistās ar pārejas stāvokli, lai palīdzētu to stabilizēt. Līdzīgi rezultāti tika iegūti 1995. gada pētījumā, ko veica Suarezs, Sordo un Sordo, izmantojot ab initio aprēķinus, lai izpētītu sēra dioksīda reakcijas ar 1,3-diēniem kinētisko un termodinamisko kontroli.
d [ ]3 d t = k [ 2]1 [ S O ] 2{\displaystyle2 {\frac {d[3]}{dt}}}=k_{2}[1][SO_{2}]^{2}}}.
Šķīdinātāja ietekme
Šķīdinātāja ietekme uz 3,4-dimetil-2,5-dihidrotiofēn-1,1-dioksīda (attēlā pa labi) heletropisko reakciju (attēlā pa labi) tika kinētiski pētīta 14 šķīdinātājos. Tika konstatēts, ka reakcijas ātruma konstantes tiešajā un apgrieztajā virzienā, kā arī līdzsvara konstantes ir lineāri saistītas ar šķīdinātāja polaritātes skalu ET(30).
Reakcijas notika 120 °C temperatūrā, un tās pētīja ar reakcijas maisījuma 1H-NMR spektroskopiju. Tika konstatēts, ka, pārejot no cikloheksāna uz metanolu, tiešais ātrums k1 samazinās 4,5 reizes. Tika konstatēts, ka reversais ātrums k-1, pārejot no cikloheksāna uz metanolu, palielinās 53 reizes, bet līdzsvara konstante Keq samazinās 140 reizes. Tiek uzskatīts, ka aktivācijas procesa laikā mainās polaritāte, par ko liecina sakarības starp līdzsvara un kinētiskajiem datiem. Autori apgalvo, ka reakciju, šķiet, ietekmē šķīdinātāja polaritāte, un to var pierādīt ar dipolu momentu izmaiņām, pārejot no reaģenta uz pārejas stāvokli un produktu. Autori arī norāda, ka heletropisko reakciju, šķiet, neietekmē ne šķīdinātāja skābums, ne bāziskums.
Šī pētījuma rezultāti ļauj autoriem sagaidīt šādu uzvedību:
1. Šķīdinātāja polaritātes maiņa ietekmē ātrumu mazāk nekā līdzsvars.
2. Ātruma konstantes raksturos pretēja polaritātes ietekme: k1 nedaudz samazināsies, palielinoties ET(30), un k-1 palielināsies tādos pašos apstākļos.
3. Ietekme uz k-1 būs lielāka nekā uz k1.

1,2-dimetilidēnecikloheksāna reakcija ar SO2, kas dod sultilēnu, izmantojot heterodilsa-Aldera reakciju kinētiskā kontrolē, vai sulfolēnu, izmantojot heletropisko reakciju termodinamiskā kontrolē

Ierosinātais pārejas stāvoklis 1,2-dimetilidēnecikloheksāna reakcijai ar SO2, lai iegūtu sulfolēnu, izmantojot heletropisko reakciju
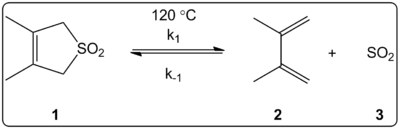
Dažādos šķīdinātājos pētīta heletropiskā reakcija
Karbēnu pievienošana alkēniem
Viena no sintētiski vissvarīgākajām hletropiskajām reakcijām ir singletkarbēna pievienošana alkenam, lai iegūtu ciklopropānu (sk. attēlu kreisajā pusē). Karbēns ir neitrāla molekula, kas satur divvērtīgu oglekli ar sešiem elektroniem valences apvalkā. Tāpēc karbēni ir ļoti reaktīvi elektrofili un rodas kā reakcijas starpprodukti. Singletā karbēnam ir tukša p orbitāle un aptuveni sp 2hibrīda orbitāle, kurā ir divi elektroni. Singletkarbēni stereospecifiski pievienojas alkeniem, un ciklopropāna produktā saglabājas alķēna stereohēmija. Karbēna pievienošanas alķēnam mehānisms ir saskaņota [2+1] cikloadikcija (sk. attēlu). Karbēnus, kas iegūti no hloroforma vai bromoforma, var izmantot, lai pievienotu CX2 alkēnam, iegūstot dihalociklopropānu, bet Simmons-Smita reaģents pievieno CH. 2
Aizpildītās karbēna orbitāles mijiedarbība ar alķēna π sistēmu rada četru elektronu sistēmu un veicina nelineāru pieeju. Ir arī labvēlīgi sajaukt karbēna tukšo p orbitāliju ar aizpildīto alķēna π orbitāliju. Labvēlīga sajaukšanās notiek, izmantojot nelineāru pieeju (skatīt 2. attēlu labajā pusē). Tomēr, lai gan teorija nepārprotami atbalsta nelineāro pieeju, nav acīmredzamas eksperimentālas ietekmes uz lineāro vai nelineāro pieeju.

Karbēna pievienošana alkēnam, lai veidotu ciklopropānu

2. attēls. A) Singletkarbēnu orbitāles B) Karbēna sp2 orbitāles un b) karbēna p orbitāles nelineāra pieeja.
Meklēt
![{\displaystyle {\frac {d[3]}{dt}}=k_{2}[1][SO_{2}]^{2}}](https://www.alegsaonline.com/image/a02f69dd0783356fbf24499f57d0df29cd264f16.svg)