Alkīni — definīcija, struktūra un reakcijas
Alkīni — definīcija, struktūra un reakcijas: uzzini par trīskāršajām saitēm, īpašībām, addīciju, reducēšanu, pericikliskām reakcijām un to pielietojumu ķīmijā.
Alkins ir molekula, kurai starp diviem oglekļa atomiem ir trīskāršā saite. To vispārīgā formula ir CnH2n-2. Tos sauc arī par acetilēniem. Mazākais alkīns ir acetilēns (etīns, C2H2). Alkīni parasti ir nepolāri un hidrofobi: tie labi šķīst organiskajos šķīdinātājos, bet slikti šķīst ūdenī. Alkīni ir viegli uzliesmojoši un jāuzglabā piesardzīgi.
Struktūra un hibridizācija
Trīskāršā saite sastāv no viena σ- un divām π-saistībām. Oglekļa atomi, kas veido trīskāršo saiti, ir sp-hibridizēti, tāpēc to ģeometrija ir lineāra (saikņu leņķis apmēram 180°). Tā rezultātā alkīnu ķēdes vieta pie trīskāršās saites ir lineāra, bet atlikusī molekulas daļa var būt izliektāka atkarībā no atlikušajiem atomiem.
Klasifikācija
Alkīnus iedala divos pamatveidos:
- Terminālie (galapunktēti) alkīni — trīskāršā saite atrodas molekulas galā (piem., etīns, proparilveida). Terminālie alkīni ir vieglāk deprotonējami un tiem ir salīdzinoši mākslīga skābuma īpašība (pKa apmēram 25).
- Internie alkīni — trīskāršā saite atrodas ķēdes iekšienē (piem., 2-butin). Tie nav termināli un parasti nav skābi.
Fizikālās īpašības
- Nelieli alkīni ir gāzes vai viegli šķidrie savienojumi ar salīdzinoši augstāku viršanas temperatūru nekā atbilstošie alķēni.
- Nešķīst ūdenī, bet šķīst organiskajos šķīdinātājos.
- Reaktivitāte pret elektrofīliem reagējošiem reaģentiem un spēja veidot stabilas acetilīdjonu bāzes terminālajos alkīnos.
Chemiskās īpašības un svarīgākās reakcijas
Alkīni ir reaktīvāki nekā daudzi citi ogļūdeņraži, bieži vien reaktīvāki arī par alkēniem. Galvenās reakcijas:
- Adīcijas reakcijas: pie trīskāršās saites var pievienoties H2, X2 (halogēni), HX u.c. Piemēram, hidrogenēšana ar H2 un katalizatoru (Pd, Pt) pārvērš alkīnu par alkānu; daļēja hidrogenēšana ar Lindlara katalizatoru (Pd/BaSO4 modificēts) dod cis (Z) dubultsaiti, bet reducēšana ar naftai raksturīgu metālu šķīdumu (piem., Na / NH3) dod trans (E) dubultsaiti.
- Hydratācija: H2O / H2SO4 / HgSO4 pie terminaliem alkīniem parasti dod ketonus (Markovņikova pievienošanās ar enola tautomerizāciju). Alternatīvi, hidroborācija–oksidācija (BH3, pēc tam H2O2/NaOH) pie terminaliem alkīniem dod anti‑Markovņikova produktu — galvenokārt aldehīdus.
- Halogenēšana: X2 pievienošanās pārvērš tripleitu pakāpeniski par dihalogenētām vai tetrahalogenētām struktūrām atkarībā no stoihiometrijas.
- Deprotonācija un alkilēšana: terminālos alkīnus var deprotonēt ar spēcīgām bāzēm (piem., NaNH2, BuLi), veidojot acetilīdjonu (R–C≡C−), kas ir labs nukleofils alkilēšanai (SN2) — tas ļauj pagarināt oglekļa ķēdi un sintētiski veidot iekšējos alkīnus.
- Oxidatīvā šķelšana: spēcīgas oksidējošas vielas (KMnO4, ozons) šķeļ trīskāršo saiti un veido karboksilskābes, bet terminālos alkīnus var pilnībā oksidēt līdz CO2 kā vienam no produktiem.
- Pericikliskās reakcijas: alkīni tiek izmantoti dažādās pericikliskajās reakcijās, tostarp [2+2+2] cikloadīcēs un citos ciklizācijas procesos, lai veidotu aromātiskus vai heterociklus ringus.
Sinteze un iegūšana
- Laboratoriskā sintēzē alkīnus bieži iegūst, veicot divkāršu dehidrohalogenāciju no geminālajiem vai vicinālajiem dihalogenīdiem (piem., izmantojot stipras bāzes kā KOH vai NaNH2).
- Terminālos alkīnus var iegūt arī, alkilējot acetilīdjonus (R–C≡C− + R'X → R–C≡C–R').
- Industriāli acetilēnu var iegūt no kalcija karbīda reakcijas ar ūdeni (CaC2 + 2H2O → C2H2 + Ca(OH)2) vai no parciālās metāna oksidācijas vai no naftas frakciju krakēšanas.
Praktiskie pielietojumi
- Acetilēns tradicionāli izmantots metināšanā un griešanā (oksacetilēna liesma), jo tam ir augsta sadegšanas temperatūra.
- Alkīni ir svarīgi izejmateriāli ķīmiskajā rūpniecībā — vinilēna, ftalātu, farmaceitu un agroķīmisku savienojumu sintēzē.
- Organiskajā sintēzē tos plaši izmanto ķēžu paplašināšanai, ciklizācijām un uzbūves elementu veidošanai sarežģītākām molekulām.
Drošība un apstrāde
Daudzi alkīni, īpaši acetilēns, ir ļoti uzliesmojoši un var veidot sprādzienbīstamas maisījumus ar gaisu. Acetilēns pie spiediena vai akūta mehāniskā stresa var eksplodēt, tāpēc tā uzglabāšana un transportēšana jāveic atbilstoši standartiem. Raksturīga arī toksicitāte un kairinājums — jāievēro piemērota ventilācija, aizsargapģērbs un nedrīkst atstāt bez uzraudzības reakcijas, kurās rodas gāzes vai siltums.
Īsumā, alkīni ir nozīmīga ogļūdeņražu grupa ar unikālu trīskāršās saites uzvedību, plašu reakciju spektru un daudzām praktiskām pielietošanas iespējām ķīmijas un rūpniecības jomā.
Struktūra
Alkīniem ir 180 grādu leņķis starp diviem oglekļa atomiem. Šā iemesla dēļ tiem nepatīk būt cikliskos savienojumos. Daži alkīnu piemēri ir parādīti turpmāk.
| · v · t · e Funkcionālās grupas |
|
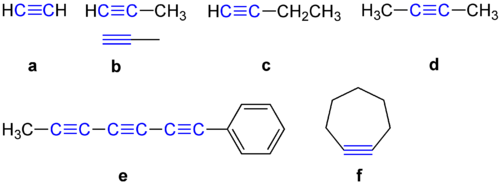
Alkīnu piemēri
Jautājumi un atbildes
J: Kas ir alkīns?
A: Alkins ir molekula, kurai ir trīskāršā saite starp diviem oglekļa atomiem.
J: Kāda ir alkīnu vispārīgā formula?
A: Alkīnu vispārīgā formula ir CnH2n-2.
J: Kāds ir mazākais alkīns?
A: Mazākais alkīns ir acetilēns, ko sauc arī par etinu.
J: Vai alkīni ir hidrofobi vai hidrofili?
A: Alkīni ir hidrofobi, tas nozīmē, ka tie labi šķīst organiskos šķīdinātājos, bet ne ūdenī.
J: Ar ko katrs alkīna secīgais loceklis atšķiras viens no otra?
A: Katrs alkīna secīgais loceklis atšķiras ar "-CH2" molekulāro formuli.
Vai alkīni ir reaktīvāki par parastajiem ogļūdeņražiem?
A: Jā, daudzās reakcijās alkīni ir reaktīvāki par parastajiem ogļūdeņražiem, piemēram, alķēniem.
J: Ko var darīt ar alkīnu molekulas beigās?
A: Ja alkīns atrodas molekulas beigās, to var viegli atdalīt, protonējot ar spēcīgu bāzi, un pēc tam izmantot aditīvās reakcijās, piemēram, pievienojot ketonam.
Meklēt