SN2 reakcija — bimolekulāra nukleofīlā aizvietošana: definīcija un mehānisms
SN2 reakcija — bimolekulāra nukleofīlā aizvietošana: skaidra definīcija, detalizēts mehānisms, kinetika, faktoru ietekme un praktiski piemēri.
SN 2 reakcija (pazīstama arī kā bimolekulāra nukleofīlā aizvietošana) ir aizvietošanas reakcija organiskajā ķīmijā. Tas ir nukleofīlas aizvietošanas veids, kurā nukleofila vientuļais pāris uzbrūk elektrondeficītam elektrofīlajam centram un savienojas ar to. Tādējādi tiek izstumta cita grupa, ko sauc par "aizejošo grupu". Tādējādi ienākošā grupa vienā solī nomaina aizejošo grupu. Tā kā reakcijas lēnajā, ātrumu noteicošajā reakcijas posmā piedalās divas reaģējošās sugas, tas ir iemesls nosaukumam bimolekulārā nukleofīlā aizvietošana jeb SN 2. Neorganiskās ķīmijas speciālistu vidū reakciju SN 2 bieži dēvē par apmaiņas mehānismu.
Mehānisms — kas notiek molekulā
SN2 ir koncertēta (vienpakāpju) reakcija: nukleofīls uzbrūk no atoma pretējās puses (backside attack) salīdzinājumā ar aizejošo grupu. Uzbrukuma laikā veidojas pārejas stāvoklis ar daļēji izveidotām saitēm pie centra (bieži raksturots kā pentakoordinēts vai piecpusējs pārejas stāvoklis), pēc tam aizejošā grupa tiek izstumta un veidojas galaprodukts. Šāds mehānisms parasti izraisa stereokemisku inversiju pie centra, ko sauc par Waldena inversiju.
Kinetika un ātruma likums
SN2 reakcijas ātrums atbilst bimolekulāram ātruma likumam:
- rate = k [nukleofīls] [substrāts]
Tas nozīmē, ka ātrumu ietekmē gan nukleofīla, gan elektrofīlā substrāta koncentrācijas.
Faktori, kas ietekmē SN2
- Substrāta struktūra: steriska aizsardzība ir kritiska — reakcijas ātrums parasti samazinās secībā: metils > primārs > sekundārs. Tercierie centri praktiski neveic SN2 sakarā ar sterisko bloķēšanu.
- Nukleofīla spēks: spēcīgāki nukleofīli (bieži bāziskāki vai vairāk polarizēti joniski) veicina SN2. Tomēr polarizācija un solvatācija arī spēlē lomu — lieli, viegli polarizējami anjoni (piem., I–) var būt labāki nukleofīli šķīdumā.
- Aizejošās grupas spēja: labas aizejošās grupas (piem., I–, Br–, tosilāts) atvieglo reakciju; slikta aizejošā grupa (piem., OH– bez aktivācijas) palēnina vai aptur SN2.
- Šķīdinātājs: polarie aprotiskie šķīdinātāji (piem., DMSO, DMF, acetons) parasti veicina SN2, jo tie mazāk solvatē (un tādējādi neiznīcina) nukleofīlu. Polarie protiskie šķīdinātāji (piem., ūdens, alkoholi) solvatē anjonus un samazina to reaktivitāti.
- Temperatūra: Augstāka temperatūra parasti paātrina reakciju, tomēr var mainīt konkurējošo ceļu (piem., vairāk E2 iznākumu).
Stereohēmija
Sakarā ar backside uzbrukumu SN2 reakcijas pie stereocentriem rada konfigurācijas inversiju (Waldena inversija). Ja substrātā ir chirālais centrs, galaprodukts parasti parādās ar pretēju konfigurāciju pret sākotnējo.
Konkurējošie ceļi
- SN1: ja substrāts var stabilizēt karbokatjonu (piem., terciārs), reakcija var notikt caur SN1 mehānismu, kurā veidojas intermediārs karbokatjons. SN1 parasti dominē protiskos šķīdinātājos un pie labi stabilizētiem karbokatjoniem.
- E2 eliminācija: ja nukleofīls ir spēcāks bāzis un substrāts ir aizdomīgs par elimināciju, var notikt E2, īpaši pie sekundāriem un terciāriem centriem, un pie augstākas temperatūras.
Praktiski piemēri
- Alkilhalīda (R–Br) reakcija ar hidroksīdu (OH–) → alkohols (R–OH) ar SN2 mehānismu, ja R ir metils vai primārs.
- Metilhlorīda reakcija ar koncentrētu jodīda jonizāciju (Finkelšteina reakcija) rokmējoties šķīdinātājā, kur jābūt labam aizejošajam anjonam un atbilstošiem apstākļiem.
Kopsavilkums
SN2 ir vienpakāpju, bimolekulārs nucleofīlas aizvietošanas mehānisms ar raksturīgu backside uzbrukumu un stereokemisku inversiju. Reakcijas ātrumu nosaka substrāta un nukleofīla koncentrācijas, un to būtiski ietekmē substrāta steriskā piesārņotība, nukleofīla vara, aizejošās grupas kvalitāte un šķīdinātājs. Saprotot šos faktorus, ķīmijas praksē iespējams mērķtiecīgi plānot reakcijas un paredzēt to iznākumus.
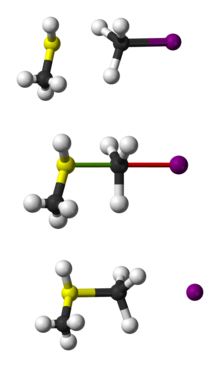
SN 2 CH3 SH reakcijas ar CH3 I attēls ar lodi un nūjiņu.
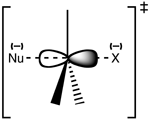
SN 2 pārejas stāvokļa struktūra
Reakcijas mehānisms
Reakcija visbiežāk notiek pie alifātiskā sp3 oglekļa centra, kuram pievienota elektronegatīva, stabila atstājošā grupa - "X" - bieži halīda atoms. C-X saites pārrāvums un jaunas C-Nu saites veidošanās notiek vienlaicīgi, veidojot pārejas stāvokli, kurā nukleofilais ogleklis ir pentakorordinēts un aptuveni sp2 hibridizēts. Nukleofils uzbrūk ogleklim 180° leņķī attiecībā pret atstāto grupu, jo tas nodrošina vislabāko pārklāšanos starp nukleofila vientuļo pāri un C-X σ* antisavienojuma orbitāliju. Pēc tam atstājošā grupa tiek izstumta no pretējās puses, un veidojas produkts.
Ja substrāts, kuram tiek veikts nukleofīlais uzbrukums, ir hirāls, tas var novest, lai gan ne vienmēr, pie stereohēmijas inversijas, ko sauc par Valdena inversiju.
SN 2 reakcijas piemērā OH −(nukleofila) uzbrukums brometānam (elektrofilam) rada etanolu, un bromīds tiek izvadīts kā atstājošā grupa:
SN 2 reakcija notiek, ja uzbrukuma atpakaļvirzienu nebloķē citi molekulas atomi (sterili traucē substrāta aizvietotāji). Tātad šis mehānisms parasti notiek pie neapgrūtināta primārā oglekļa centra. Ja substrāts ir steriski nospiests pie atstājošās grupas, piemēram, pie terciārā oglekļa centra, aizvietošanā tiks izmantots SN 1, nevis SN 2 mehānisms (SN 1 arī būtu ticamāks bloķētās molekulās, jo varētu veidoties pietiekami stabils karbokācijas starpposma reakcija).
Koordinācijas ķīmijā asociatīvā aizvietošana notiek pēc līdzīga mehānisma kā SN 2.
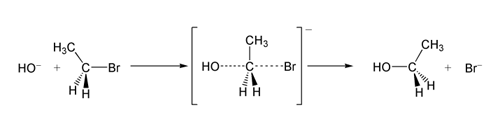
SN 2 brometāna reakcija ar hidroksīda jonu.
Faktori, kas ietekmē reakcijas ātrumu
Reakcijas ātrumu ietekmē četri faktori:
- Substrāts. Substrātam ir vissvarīgākā loma reakcijas ātruma noteikšanā. Tas ir tāpēc, ka nukleofils uzbrūk no substrāta mugurpuses, tādējādi pārraujot oglekļa atstājošās grupas saiti un veidojot oglekļa-nukleofila saiti. Tāpēc, lai maksimāli palielinātu SN 2 reakcijas ātrumu, substrāta aizmugurei jābūt pēc iespējas netraucētai. Kopumā tas nozīmē, ka visātrāk reaģē metilsubstrāti un primārie substrāti, tiem seko sekundārie substrāti. Trešie substrāti nepiedalās SN 2reakcijās, jo tiem traucē stēriskie šķēršļi.
- Nukleofils. Tāpat kā substrāts, arī nukleofila spēku ietekmē steriskā kavēšana. Piemēram, metoksīda anjons ir gan spēcīga bāze, gan nukleofils, jo tas ir metila nukleofils, un tādējādi tas ir ļoti netraucēts. Tert-butoksīds, no otras puses, ir spēcīga bāze, bet vājš nukleofils, jo tā trīs metilgrupas kavē tā pietuvošanos ogleklim. Nukleofila stiprumu ietekmē arī lādiņš un elektronegativitāte: nukleofilitāte palielinās, palielinoties negatīvajam lādiņam un samazinoties elektronegativitātei. Piemēram, OH- ir labāks nukleofils nekā ūdens, un I- ir labāks nukleofils nekā Br- (polārajos protiskajos šķīdinātājos). Polārā aprotiskā šķīdinātājā nukleofilitāte palielinās periodiskās tabulas slejā, jo starp šķīdinātāju un nukleofilu nav ūdeņraža saites. Šajā gadījumā nukleofilitāte atspoguļo bāziskumu. Tāpēc I- būtu vājāks nukleofils nekā Br- , jo tas ir vājāka bāze.
- Šķīdinātājs. Šķīdinātājs ietekmē reakcijas ātrumu, jo šķīdinātāji var ieskauj vai neskauj nukleofilu, tādējādi traucējot vai netraucējot tā tuvošanos oglekļa atomam. Polārie aprotiskie šķīdinātāji, piemēram, tetrahidrofurāns, ir labāki šķīdinātāji šai reakcijai nekā polārie proktiskie šķīdinātāji, jo polārie proktiskie šķīdinātāji tiks šķīdināti, šķīdinātājam veidojot ūdeņraža saites ar nukleofilu. Tas traucē tam uzbrukt ogleklim ar atstāto grupu.
- Izbraukšana no grupas. Atstājošā grupa ietekmē reakcijas ātrumu. Jo stabilāka ir atstājošā grupa, jo lielāka ir iespēja, ka, nukleofilam uzbrūkot ogleklim, tā paņems divus elektronus no oglekļa atstājošās grupas saites. Tāpēc, jo vājāka ir atstājošā grupa kā konjugētā bāze, jo labāka ir atstājošā grupa. Līdzīgi, jo spēcīgāka ir atbilstošā skābe, jo labāka ir atdalītā grupa. Labu atdalītāju grupu piemēri ir halogenīdi (izņemot fluorīdu) un tosilāti. Taču HO- un H2 N- nav labas atstājošās grupas.
Reakcijas kinētika
SN 2 reakcijas ātrums ir otrās kārtas, jo ātrumu noteicošais posms ir atkarīgs no nukleofila koncentrācijas [Nu− ], kā arī no substrāta koncentrācijas [RX].
r = k[RX][Nu− ]
Tā ir galvenā atšķirība starp SN 1 un SN 2 mehānismiem. SN 1 reakcijā nukleofils uzbrūk pēc ātrumu ierobežojošā posma beigām. Bet SN 2 reakcijā nukleofils ierobežojošajā reakcijas posmā izspiež atdalīto grupu. Citiem vārdiem sakot, SN 1 reakcijas ātrums ir atkarīgs tikai no substrāta koncentrācijas, bet SN 2 reakcijas ātrums ir atkarīgs gan no substrāta, gan nukleofila koncentrācijas. Gadījumos, kad iespējami abi mehānismi (piemēram, pie sekundārā oglekļa centra), mehānisms ir atkarīgs no šķīdinātāja, temperatūras, nukleofila koncentrācijas vai atdalītās grupas.
SN 2 reakcijas parasti ir labvēlīgākas primārajiem alkilhalogenīdiem vai sekundārajiem alkilhalogenīdiem ar aprotisko šķīdinātāju. Sterisko šķēršļu dēļ terciārajos alkilhalogenīdos tās notiek ar niecīgu ātrumu.
SN 2 un SN 1 ir divas reakciju skalas galējības. Ir iespējams atrast daudzas reakcijas, kuru mehānismiem piemīt gan SN 2, gan SN 1 raksturs. Piemēram, no alkilhalogenīda ir iespējams iegūt kontaktjonu pārus, kuros joni nav pilnībā atdalīti. Kad tajos notiek aizvietošana, daudzām reaģējošām molekulām stereohēmija būs apgriezta (kā SN 2), bet dažām var saglabāties konfigurācija. SN 2 reakcijas ir biežāk sastopamas nekā SN 1 reakcijas.
E2 konkurss
Bieži sastopama blakusreakcija, kas notiek SN 2 reakcijās, ir E2 eliminācija: ienākošais anjons var darboties kā bāze, nevis kā nukleofils, atdalot protonu un izraisot alķēna veidošanos. Šo efektu var demonstrēt gāzu fāzes reakcijā starp sulfonātu un vienkāršu alkilbromīdu, kas notiek masas spektrometrā:
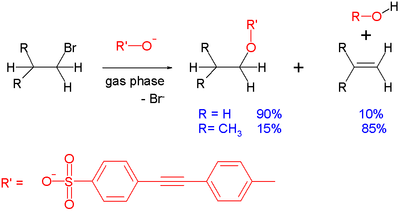
Ar etilbromīdu reakcijas produkts ir galvenokārt aizvietošanas produkts. Palielinoties steriskajai barjerai ap elektrofīlo centru, kā tas ir izobutilbromīda gadījumā, aizvietošanai nav labvēlīga ietekme, un dominējošā reakcija ir eliminācija. Citi faktori, kas veicina elimināciju, ir bāzes stiprums. Ar mazāk bāzisku benzoāta substrātu izopropilbromīds reaģē ar 55 % aizvietošanu. Kopumā šāda veida reakcijām gāzes fāzē un šķīduma fāzē ir vienādas tendences, lai gan pirmajā gadījumā šķīdinātāja ietekme ir mazāka.
Apļveida kustības mehānisms
2008. gadā uzmanība tika pievērsta SN 2 apļveida mehānismam, kas novērots gāzu fāzes reakcijā starp hlorīda joniem un metiljodīdu, izmantojot īpašu metodi, ko sauc par krustotu molekulāro staru attēlu. Ja hlorīda joniem ir pietiekams ātrums, pēc sadursmes radušos jodīda jonu enerģija ir daudz zemāka, nekā gaidīts, un tiek izvirzīta teorija, ka enerģija tiek zaudēta metilgrupas pilnīgas apļveida aprites rezultātā ap joda atomu, pirms notiek faktiskā pārvietošana.
Saistītās lapas
- Aizstāšanas reakcija
- SN 1 reakcija
Jautājumi un atbildes
J: Kas ir SN2 reakcija?
A: SN2 reakcija ir aizvietošanas reakcija organiskajā ķīmijā, kad nukleofils uzbrūk elektrondeficītam elektrofīlajam centram, izspiežot atstāto grupu un pēc tam vienā solī to aizstājot.
J: Kāda veida aizvietošanas reakcija ir SN2 reakcija?
A: SN2 reakcija ir nukleofīlas aizvietošanas reakcijas veids.
J: Cik reaģējošo sugu piedalās SN2 reakcijas lēnajā, ātrumu noteicošajā posmā?
A: SN2 reakcijas lēnajā, ātrumu noteicošajā posmā piedalās divas reaģējošās vielas.
J: Kāda ir SN2 reakcijas nosaukuma "bimolekulārā nukleofīlā aizvietošana" nozīme?
A: SN2 reakcijas nosaukums "bimolekulārā nukleofīlā aizvietošana" attiecas uz to, ka reakcijas lēnajā, ātrumu noteicošajā posmā piedalās divas reaģējošās sugas.
J: Kas ir nukleofils SN2 reakcijas kontekstā?
A: Nukleofils ir molekula vai jons, kas atdod elektronu vientuļo pāri, lai veidotu ķīmisko saiti.
J: Kas ir elektrofils SN2 reakcijas kontekstā?
A: Elektrofils ir molekula vai jons, kas pieņem elektronu pāri, lai veidotu ķīmisko saiti.
J: Kā neorganiskās ķīmijas speciālisti bieži dēvē SN2 reakciju?
A: Neorganiskās ķīmijas speciālistu vidū SN2 reakciju bieži dēvē par apmaiņas mehānismu.
Meklēt